Tumor de Células Gigantes
Características, Diagnóstico e Tratamento
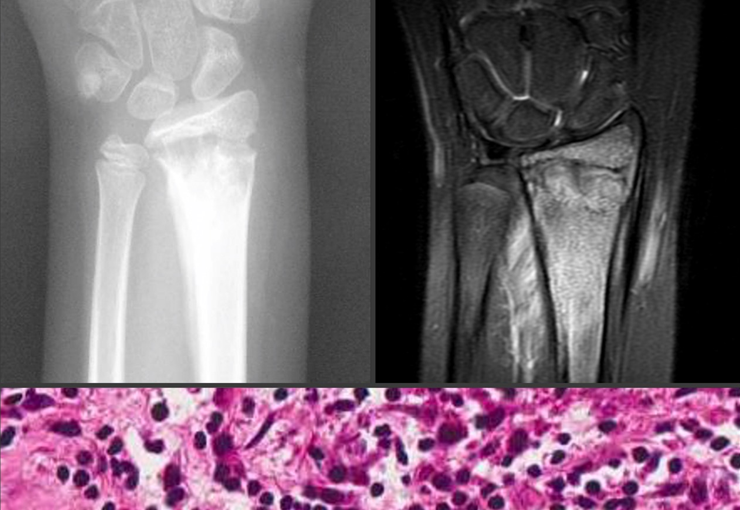
O tumor de células gigantes, também conhecido como TGC, é uma neoplasia de natureza mesenquimal que se destaca pela proliferação de células multinucleadas de grande porte, denominadas gigantócitos. Essas células assemelham-se aos osteoclastos e são encontradas em meio a um estroma de células mononucleadas. Devido à sua morfologia histológica peculiar, o diagnóstico preciso muitas vezes requer uma análise minuciosa do quadro clínico e radiográfico, a fim de evitar confusões com outros processos patológicos.
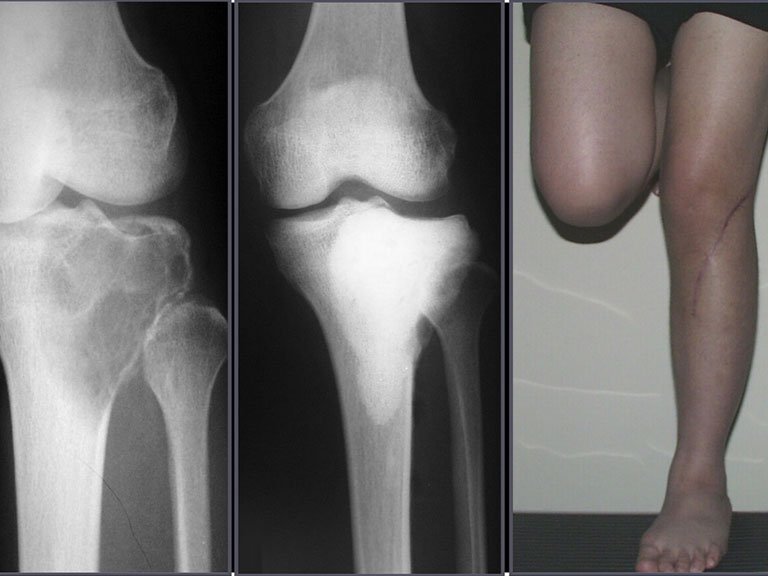
A manifestação principal do tumor gigante de células é a dor local intermitente, frequentemente acompanhada de aumento de volume na região afetada e restrição dos movimentos articulares adjacentes. O período de evolução varia de 6 a 12 meses, dependendo do osso comprometido, sendo comum relatos de trauma como desencadeador inicial dos sintomas.
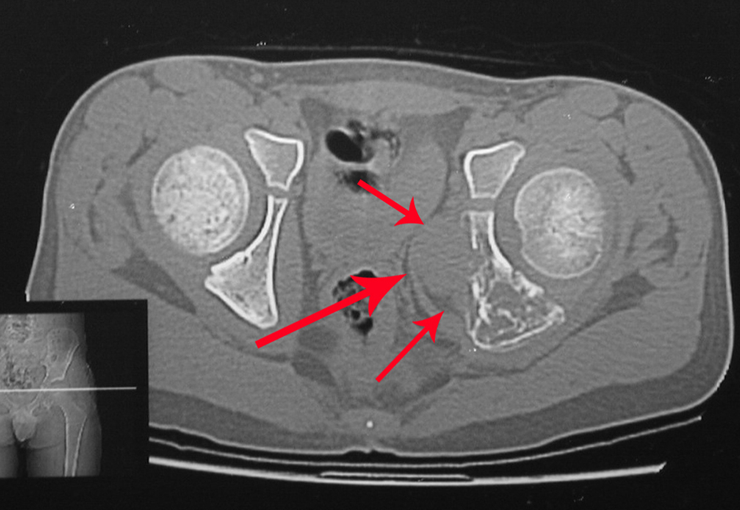
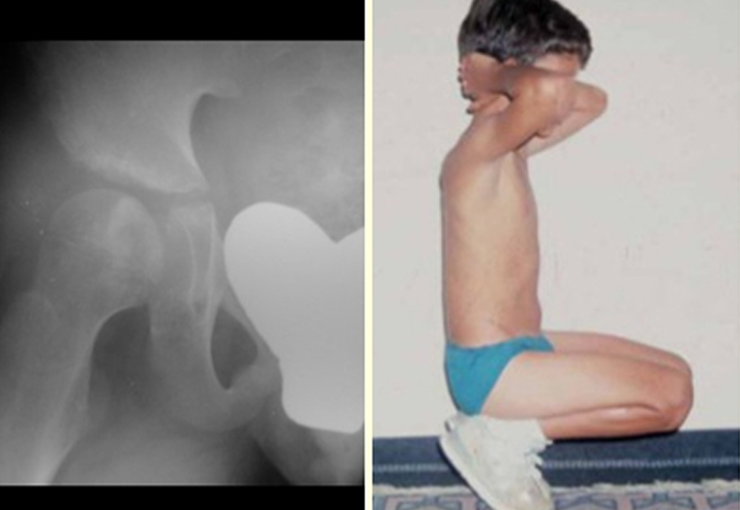
Este tipo de tumor tende a acometer um único osso, principalmente os ossos longos como o fêmur, tíbia, úmero e rádio. No entanto, em casos mais raros, pode ocorrer em ossos do esqueleto axial, com predileção pelo sacro. A incidência é mais comum entre a terceira e quarta décadas de vida, afetando igualmente ambos os sexos.
Radiograficamente, o TGC se apresenta como uma lesão epifisária caracterizada por rarefação óssea, inicialmente excêntrica e posteriormente comprometendo a cortical. A confirmação diagnóstica é obtida através da análise histológica, que revela a presença de células gigantes multinucleadas e estroma de células fusiformes.
O tratamento do tumor de células gigantes é bem estabelecido e visa à ressecção segmentar da lesão, sempre que possível, garantindo margens de segurança tanto ósseas quanto de partes moles. Nos casos em que a ressecção segmentar não é viável, como na coluna cervical, a curetagem endocavitária seguida de terapia adjuvante é indicada. Dentre as opções terapêuticas adjuvantes estão o laser CO2, o fenol diluído em álcool à 4%, o nitrogênio líquido e a eletrotermia.
A técnica da eletrotermia tem se mostrado eficaz na complementação da curetagem, proporcionando uma limpeza mais completa da cavidade tumoral. Após a eletrotermia, a fresagem da cavidade com o uso de instrumentos apropriados como o lento dril é realizada para garantir a remoção completa das células tumorais remanescentes.
O preenchimento da cavidade tratada pode ser feito com diferentes materiais, como enxerto ósseo autólogo, substitutos ósseos ou metilmetacrilato, cada um com suas vantagens e desvantagens. O acompanhamento pós-tratamento é essencial para monitorar a recorrência da doença e garantir a eficácia do tratamento realizado.
Em resumo, o tumor de células gigantes é uma condição complexa que requer uma abordagem multidisciplinar para garantir o melhor resultado terapêutico e a qualidade de vida do paciente. O avanço nas técnicas de diagnóstico e tratamento tem contribuído significativamente para melhorar o prognóstico desses pacientes, oferecendo opções terapêuticas cada vez mais eficazes e seguras.