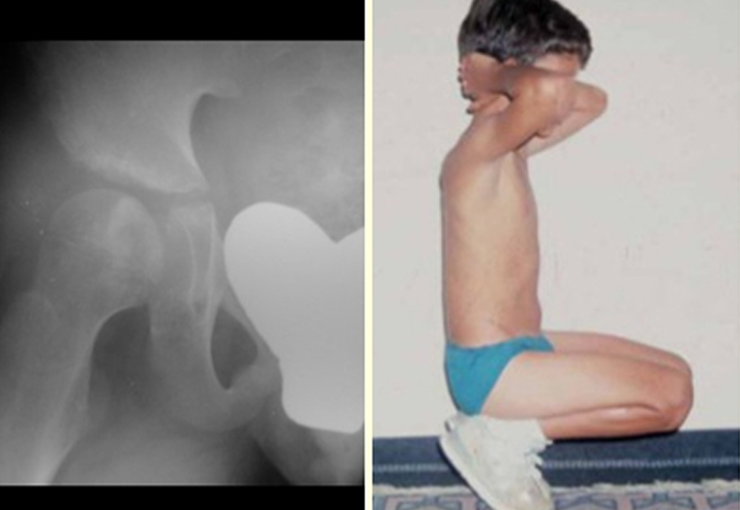
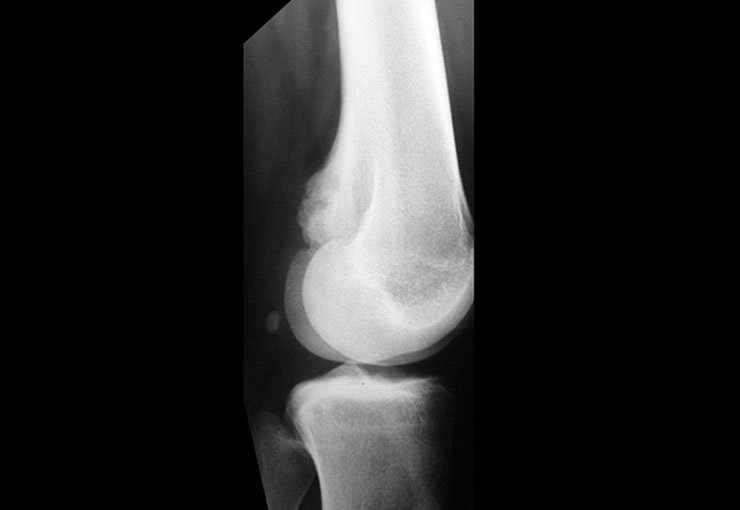
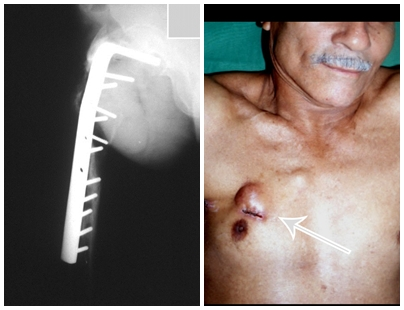
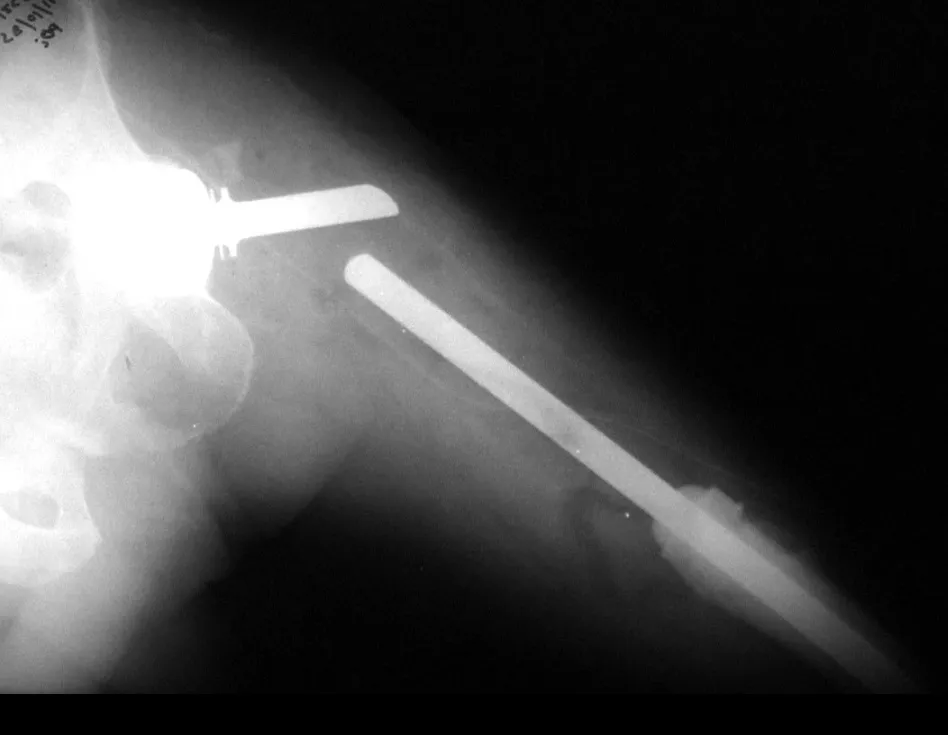
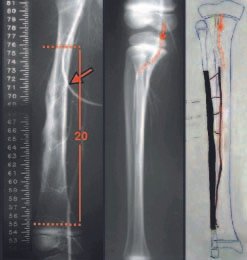
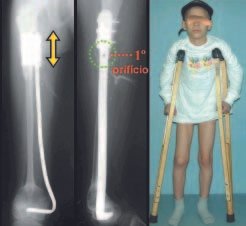
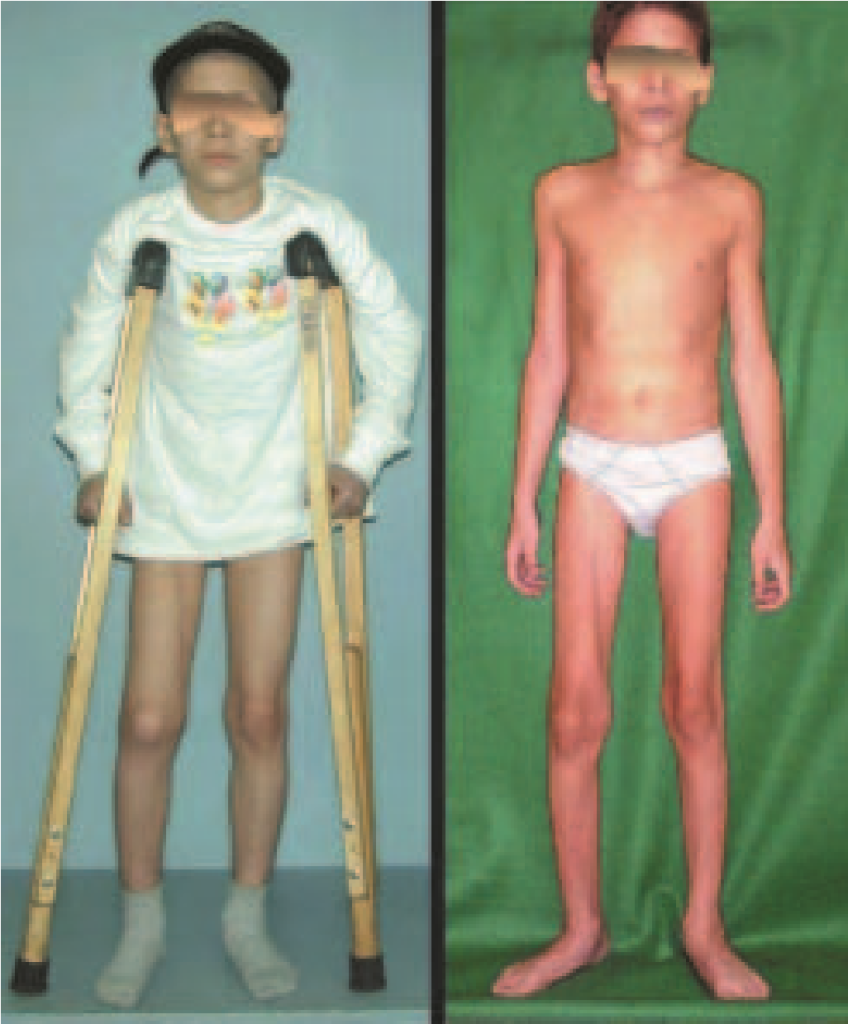
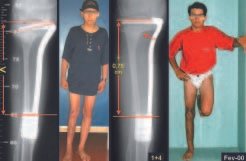
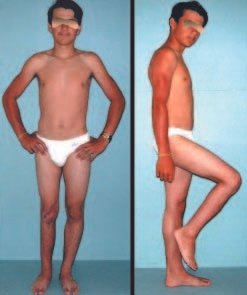
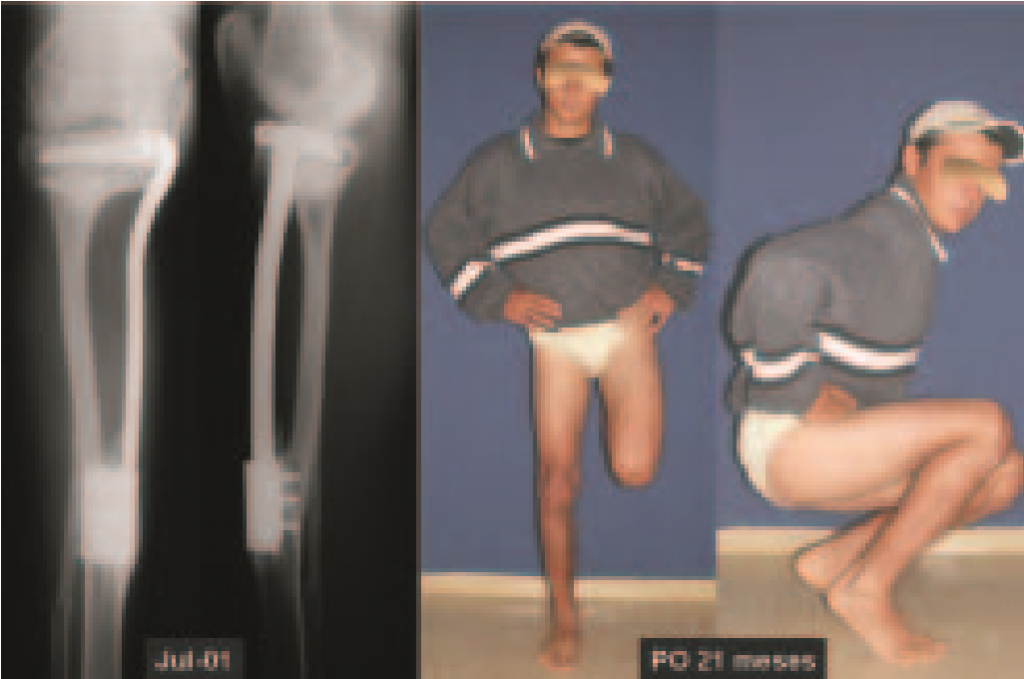
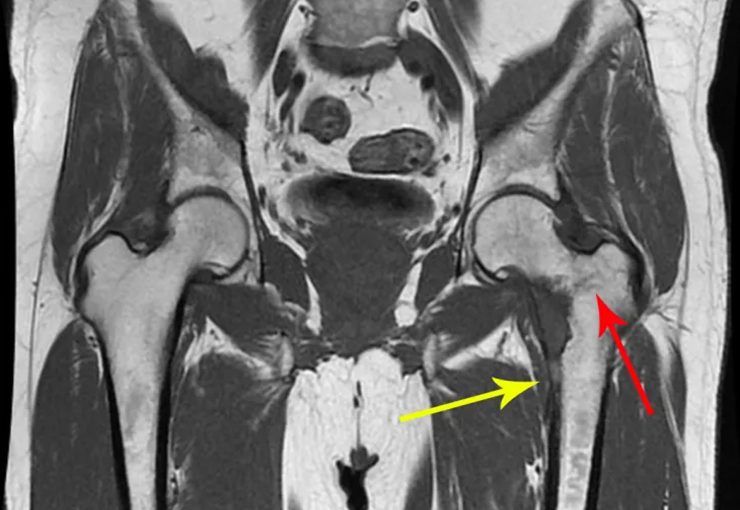
O paciente foi submetido a biópsia por trocarte da lesão no fêmur e biópsia incisional da massa na mama. Os resultados dos exames anatomopatológicos foram os seguintes: metástase de adenocarcinoma no fêmur e carcinoma ductal infiltrativo da mama. Foi realizada ressecção do terço proximal do fêmur direito e colocação de endoprótese não convencional de Fabroni (ENCF) (fig. 6). A evolução no pós-operatório imediato foi satisfatória. Duas semanas após a cirurgia, o paciente iniciou quimioterapia com ciclofosfamida, fluoracilo e farmorubicin com a finalidade de facilitar a ressecção da mama e o esvaziamento ganglionar. Atualmente (pós-operatório de seis meses), o paciente, ainda em programa de quimioterapia, apresenta marcha claudicante com auxílio de muletas, exame neurológico normal e a seguinte mobilidade do quadril direito: 90º de flexão,
–15º de extensão, 30º de abdução, 20º de adução, 60º de rotação externa e 0º de rotação interna (fig. 5, A e B).
DISCUSSÃO
O câncer de mama masculina, além de raro, tem grande agressividade, com metástases precoces aos linfonodos axilares(5). Segundo estudo feito por Gallardo et al.(2) em 303 casos de metástase óssea por câncer de mama, verificou-se que apenas 1,33% correspondia a pacientes do sexo masculino.
Não foi encontrado na literatura tratamento específico para carcinoma de mama masculina. O tratamento para metástase óssea de câncer de mama, quando não há iminência de fratura, é, essencialmente, a quimioterapia e a radioterapia. Sanoo et al.(7), utilizando terapia combinada com tamoxifen, ciclofosfamida, fluoracilo, morfina e medroxiprogesterona 17-acetato, concluíram que esta quimioterapia foi efetiva para dor óssea em 96,33% dos casos. Saez et al.(6) estudaram a sobrevivência de pacientes com metástase de câncer de mama que foram submetidos a cirurgia de ressecção, colocação de enxerto ósseo, quimioterapia e uso de agentes antineoplásicos adjuvantes. O estudo foi feito em 20 mulheres entre 24 e 56 anos de idade, das quais nove apresentaram total remissão e 11, remissão parcial. A nosso ver, o emprego de enxerto ósseo em tumores metastáticos é muito discutível. O tratamento da fratura patológica é variado. Alguns fatores, como idade, estádio da doença primária, tamanho da metástase e comprometimento clínico geral do paciente, influem no prognóstico e ajudam a escolher o melhor tratamento para a fratura(1). Em pacientes com grave comprometimento do estado geral ou grande extensão tumoral, quando as possibilidades cirúrgicas são muito limitadas, o tratamento pode ser expectante(3). Tendo o paciente condições para submeter-se a cirurgia, podem ser realizadas: 1) redução e osteossíntese com placa e cimento ósseo visando rápida solução para a fratura, 2) ressecção da lesão e colocação de endoprótese não convencional, proporcionando retorno precoce à deambulação, e 3) amputação em casos extremos(1). Devemos relembrar a importância da realização de exame físico completo em todos os pacientes para que não passe despercebida, como em nosso caso, uma tumoração na mama de vários anos de evolução. Exame físico minucioso, inclusive em casos em que não há suspeita de fratura patológica, pode permitir diagnóstico precoce da lesão, melhorando o prognóstico. Devemos ressaltar, também, a importância de incluir, no diagnóstico diferencial de lesão óssea sugestiva de metástase no homem, o carcinoma de mama como tumor primário.
Clique aqui para ver caso de metástase de hipernefroma, tratado antes de fraturar.
REFERÊNCIAS
1. Carnelase, P.G.: “Malignant tumors of bone”, in Crenshaw, A.H.: Campbell’s operative orthopedics, St. Louis, Mosby Year Book, 1992. Cap. 10, p. 263-190.
2. Gallardo, H., Gonzales, R. & Astagno, A.: Metastasis osea del cáncer de mama. Bol Acad Nal Med Nal 66: 459-471, 1988.
3. Campanacci, M.: Tumori delle ossa e delle parti molle, Bologna, Aulo Gaggi Editore, 1981. p. 456-512.
4. Pendleburg, S.C., Bilous, M. & Langlands, S.A.: Sarcomas following radiation therapy for breast cancer: a report of three cases and a review of the literature. Int J Radiat Oncol Biol Phys 31: 405-410, 1995.
5. Robins, S.L. & Cotran, R.S.: “Mama”, in Patologia estrutural e funcional, Rio de Janeiro, Interamericana, 1986. Cap. 27, p. 1158-1168.
6. Saez, R.A., Slease, R.B., Selby, G.B. et al: Long term survival after autologous bone marrow transplantation for metastatic breast carcinoma. South Med J 88: 320-326, 1995.
7. Sanoo, H., Shimozuma, K., Kurebayashi, J. et al: Systemic therapy pain relief and quality of life of breast cancer patients with bone metastasis. Gan To Kagaku Ryoho 22 (Suppl): 10-15, 1995.
AUTORES: PEDRO PÉRICLES RIBEIRO BAPTISTA, JOSÉ DONATO DE PRÓSPERO, FLORINDO VOLPE NETO, MARCOS SANMARTIN FERNANDEZ, NABIL ABISAMBRA PINILLA
Clique aqui para baixar o PDF