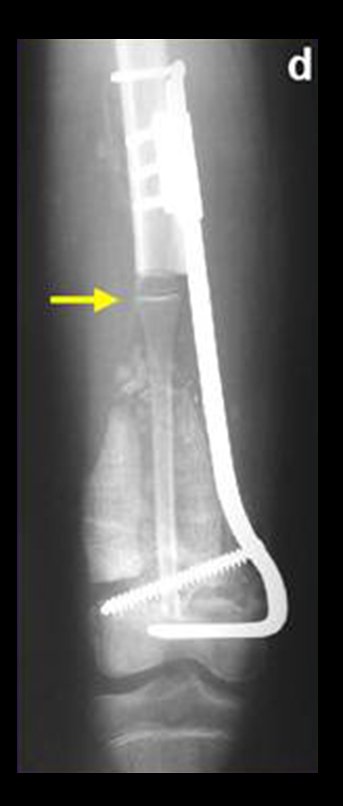
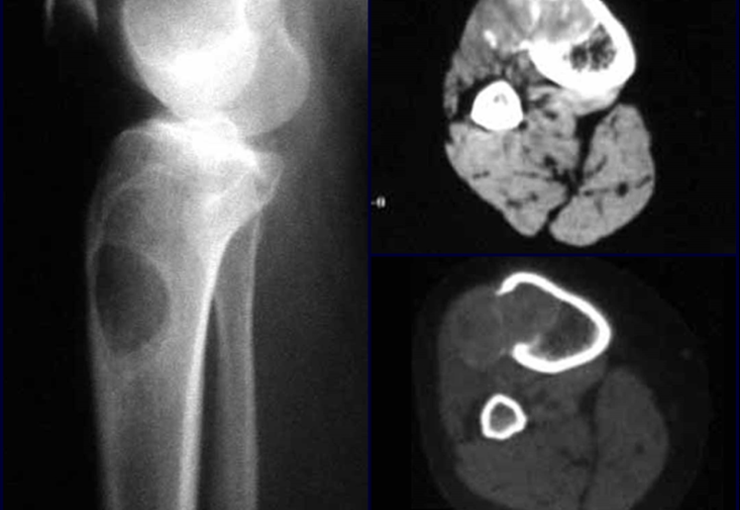
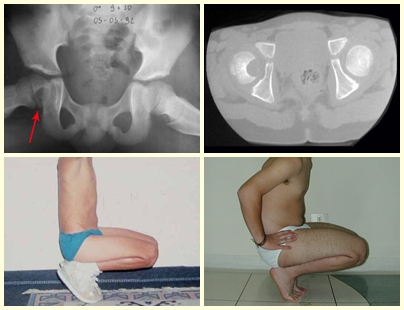
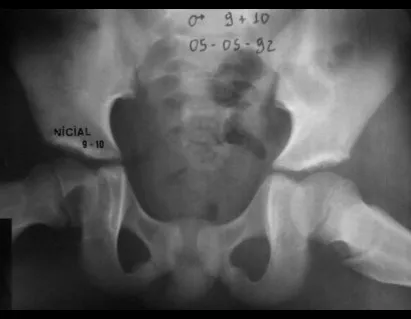
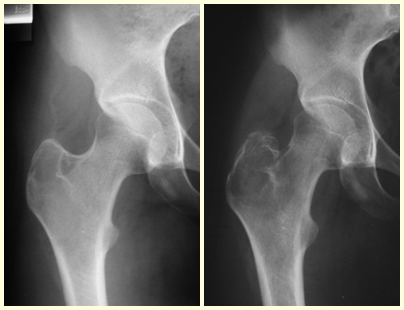
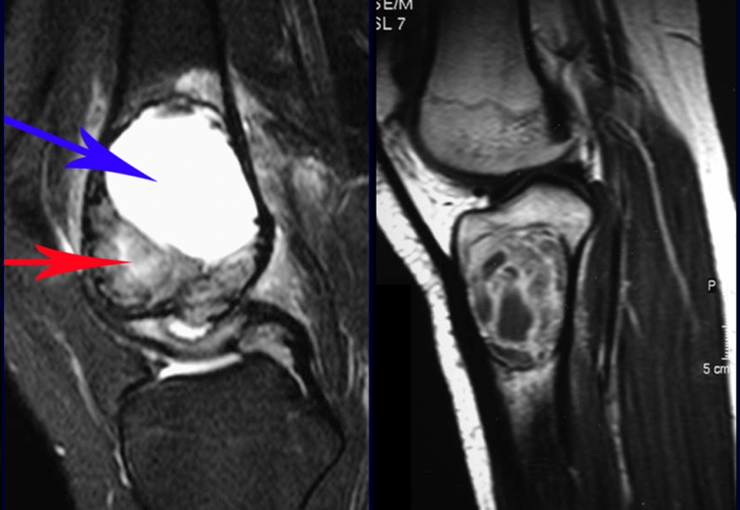
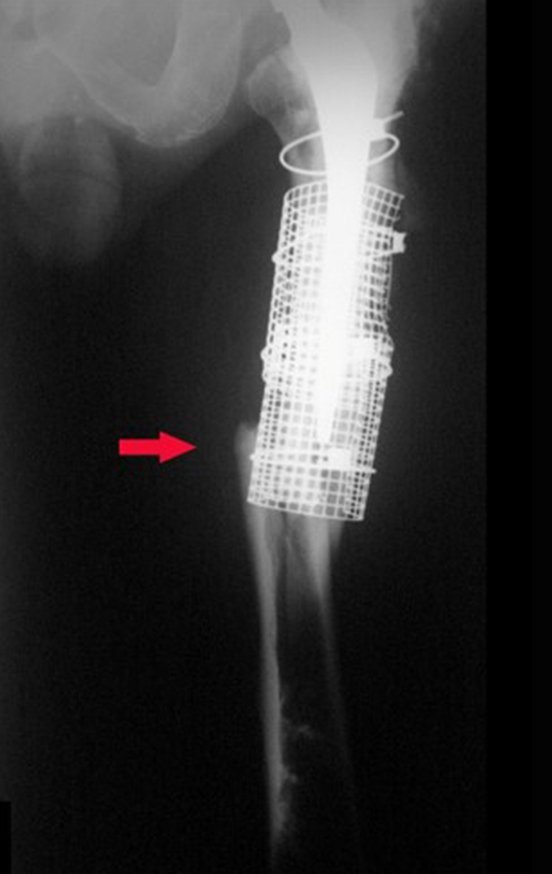
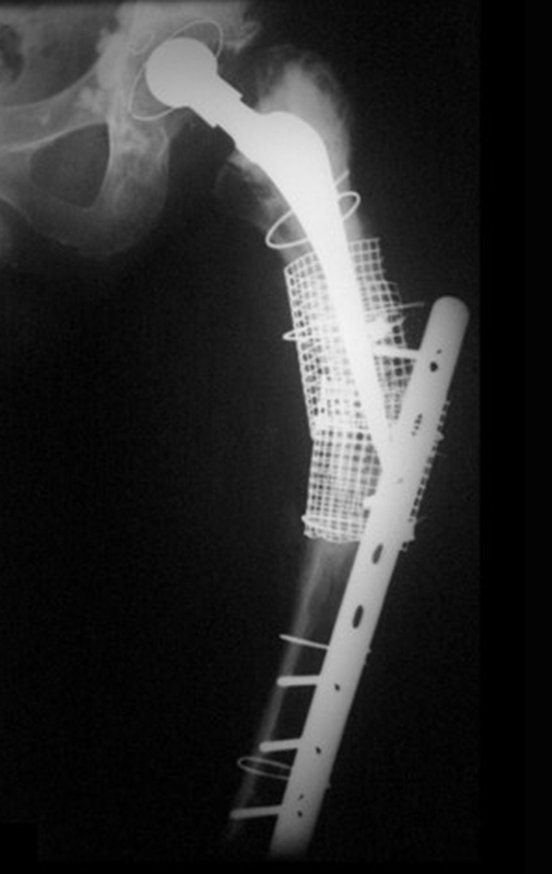
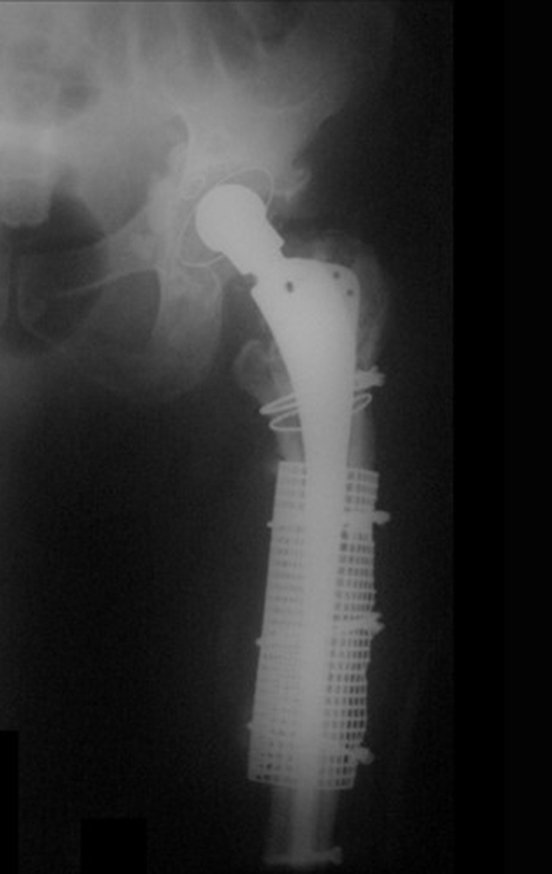
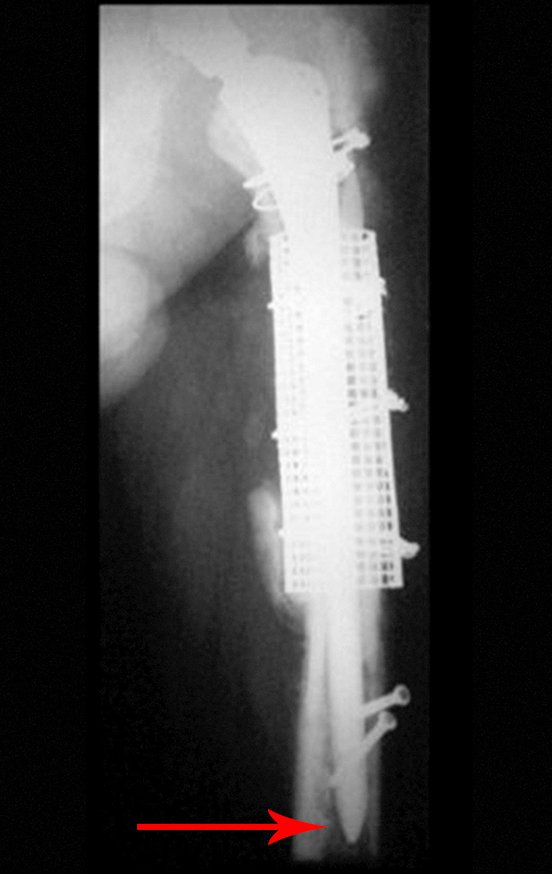
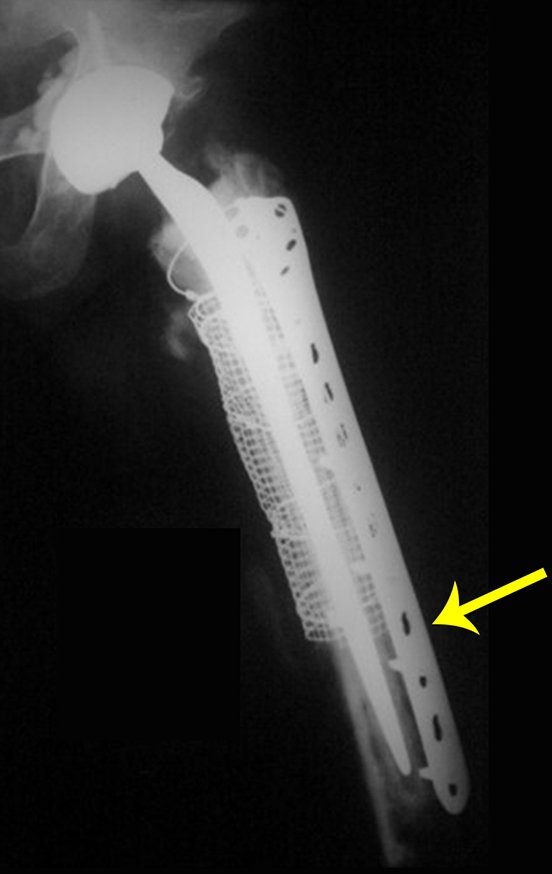
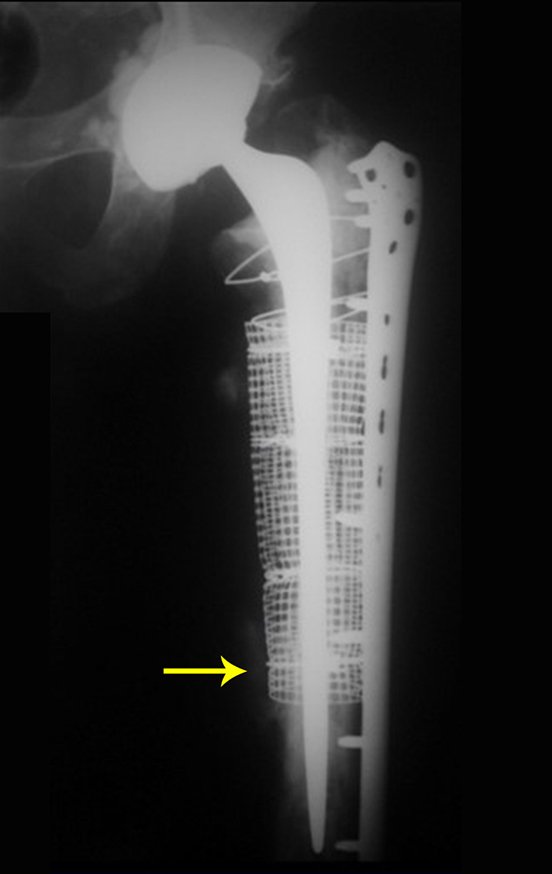
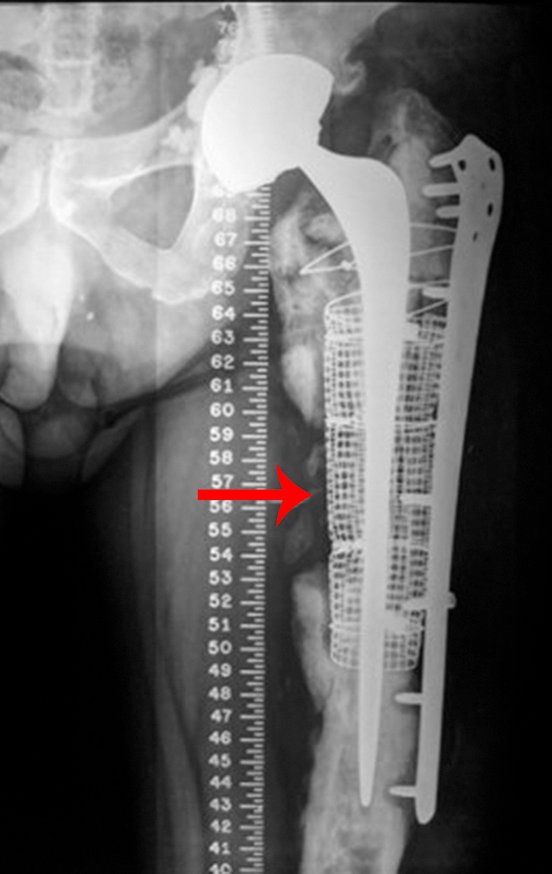
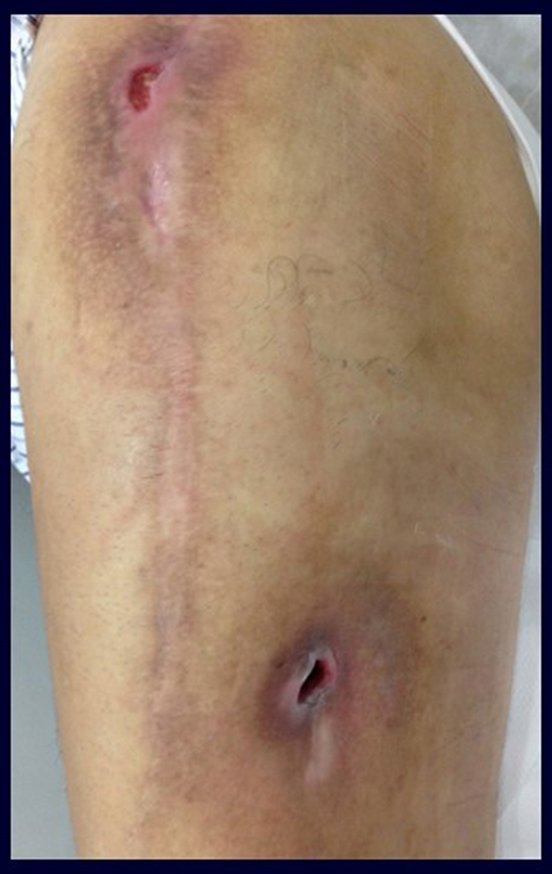
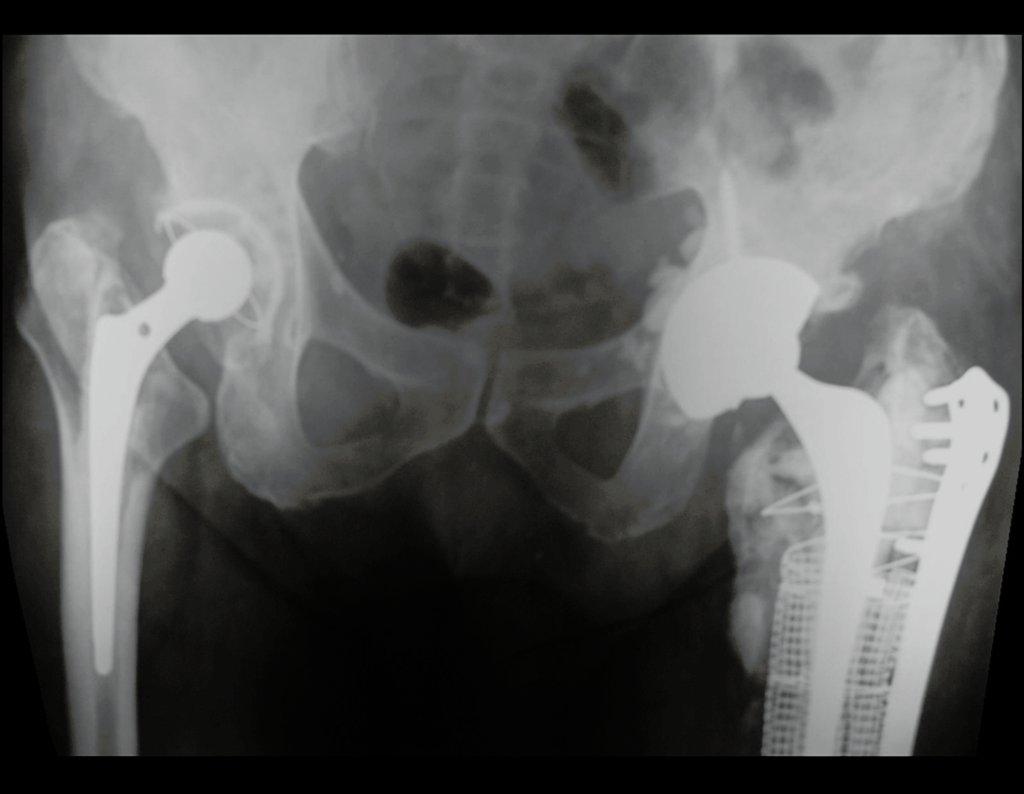
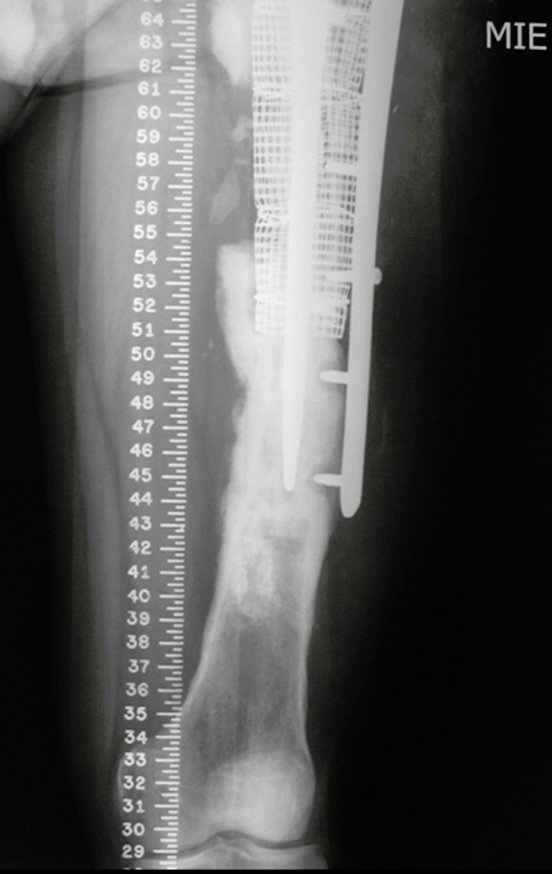
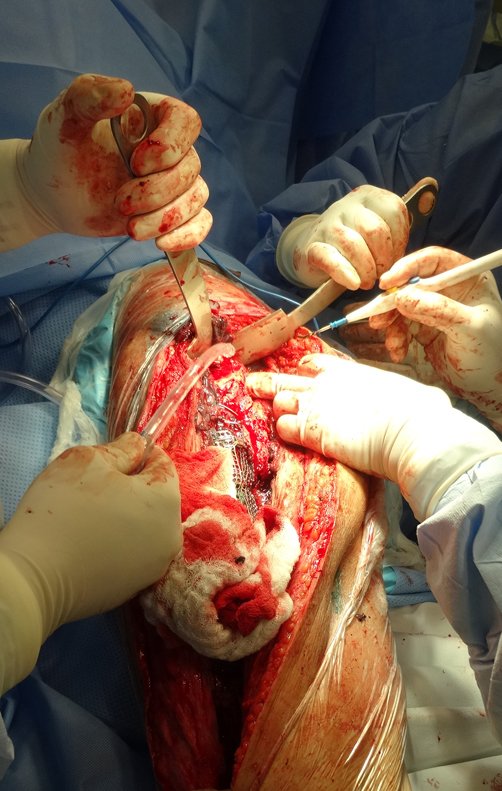
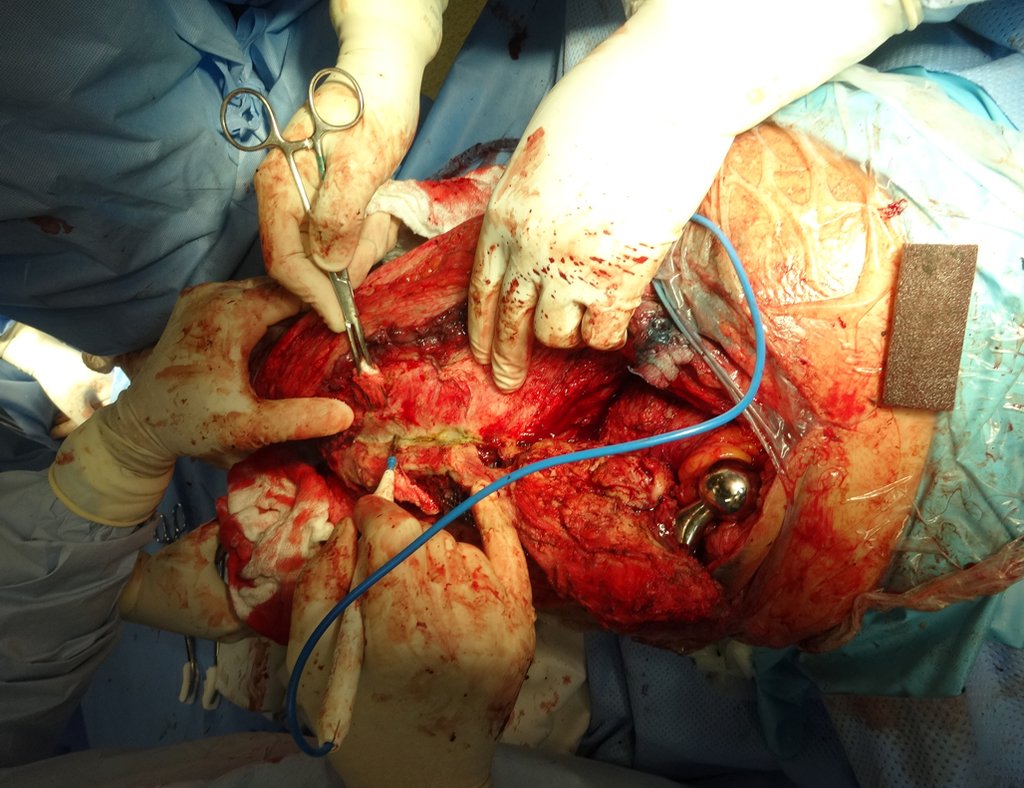
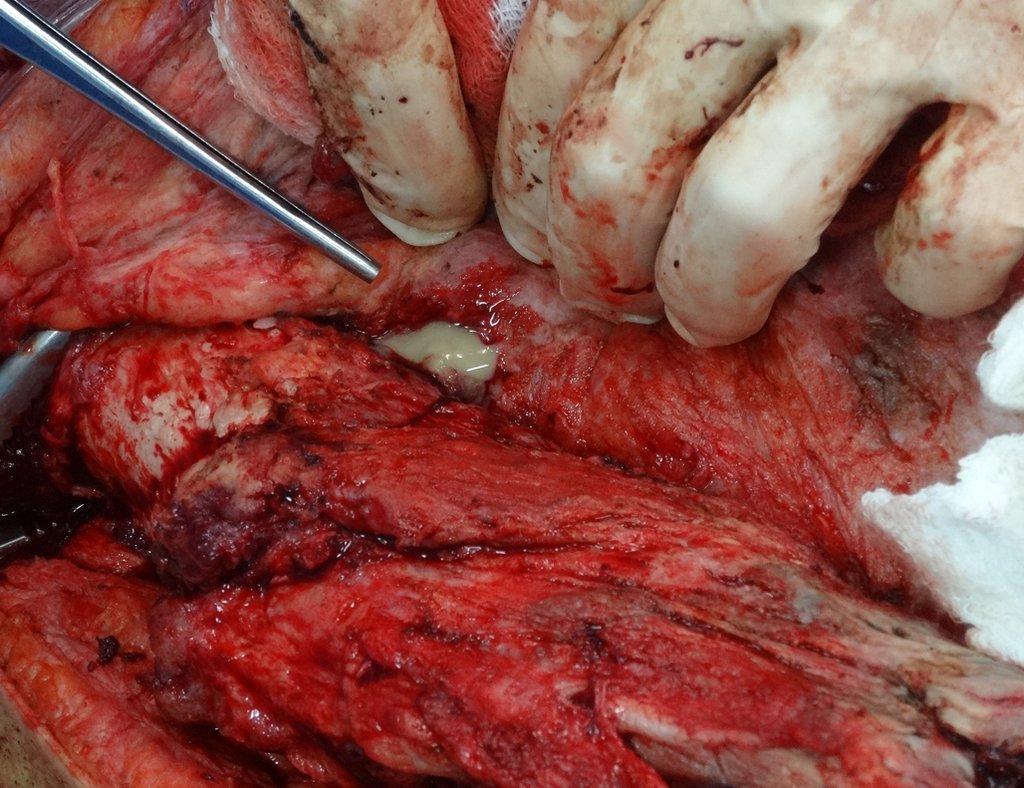
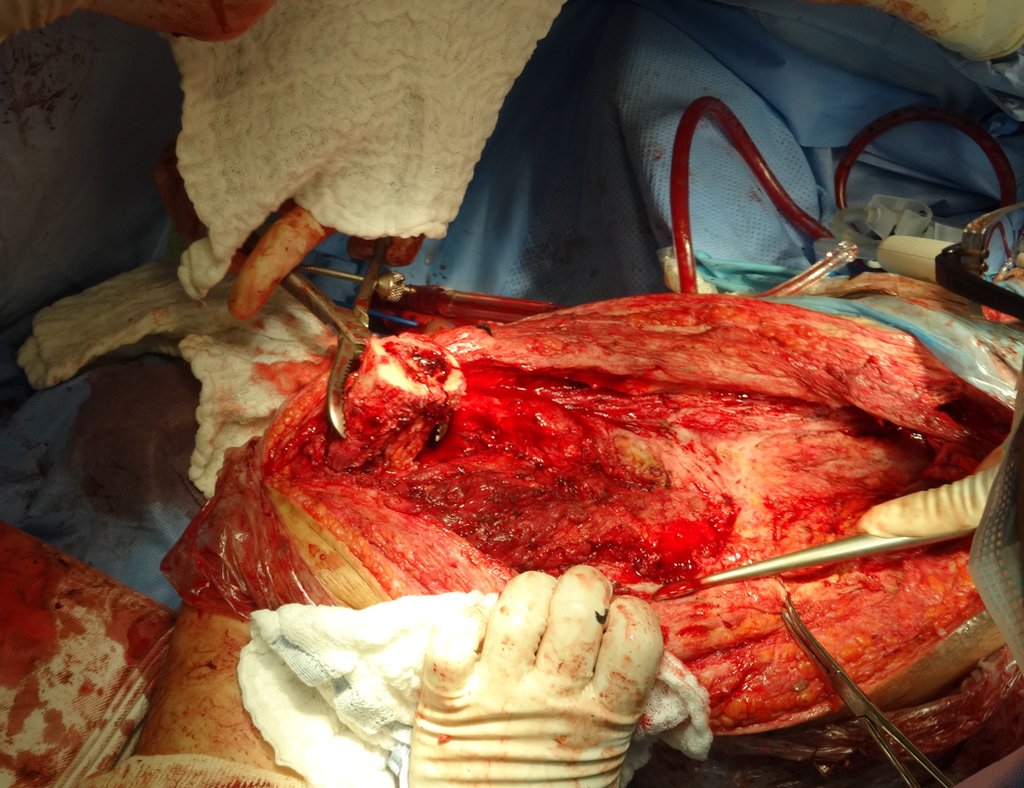
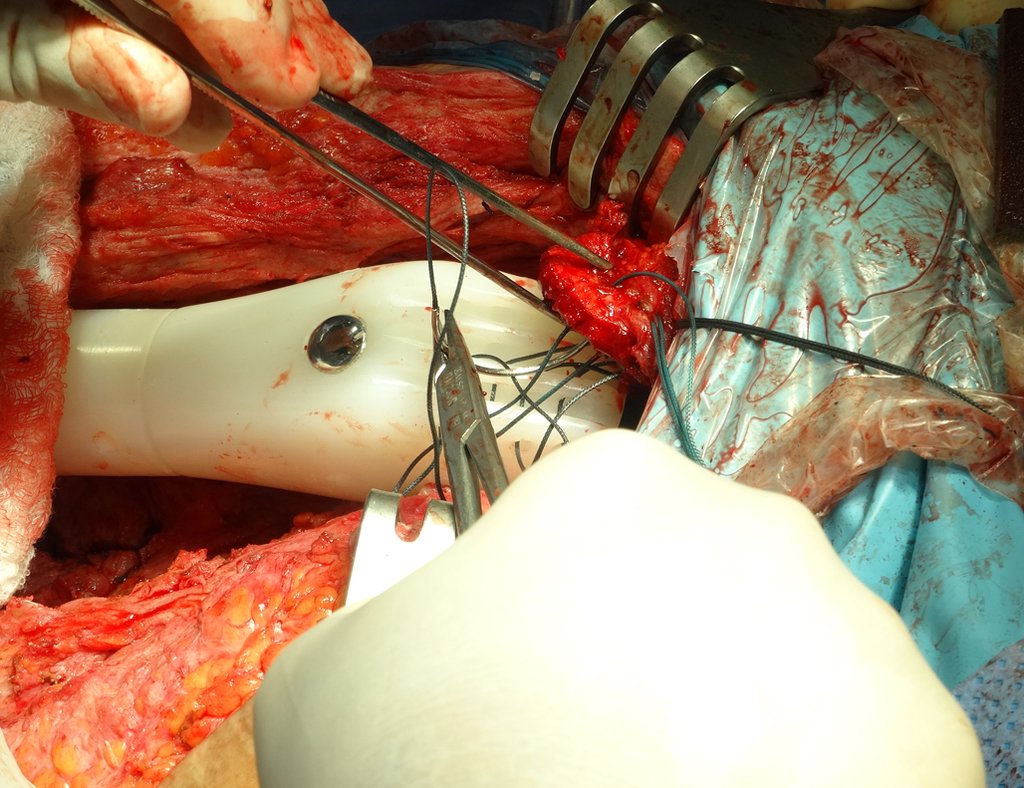
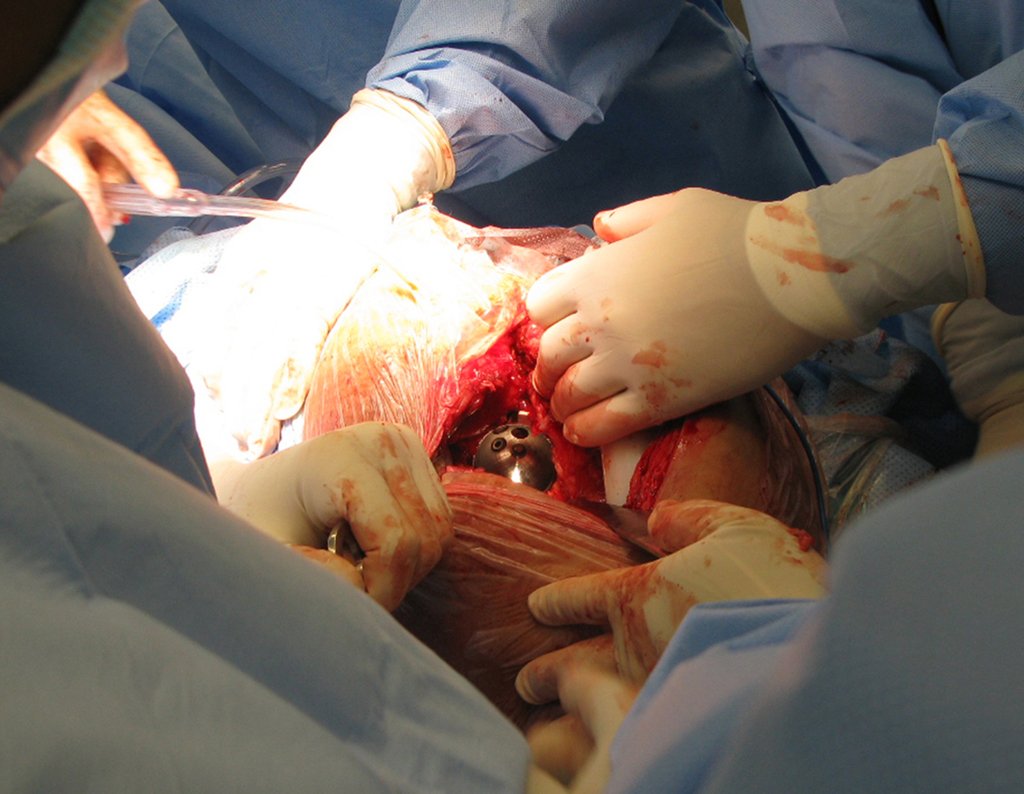
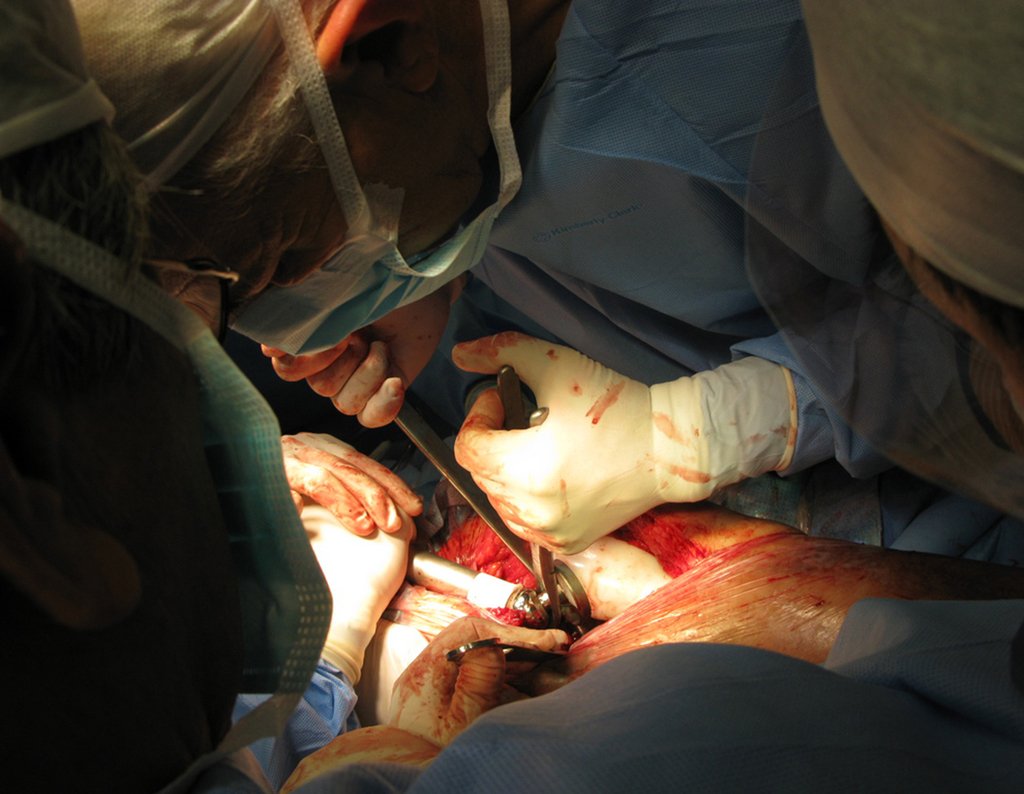
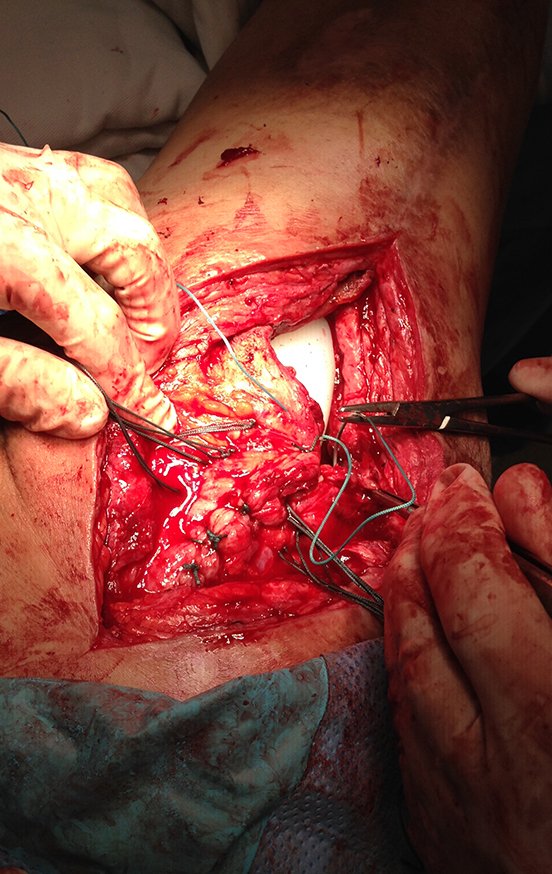
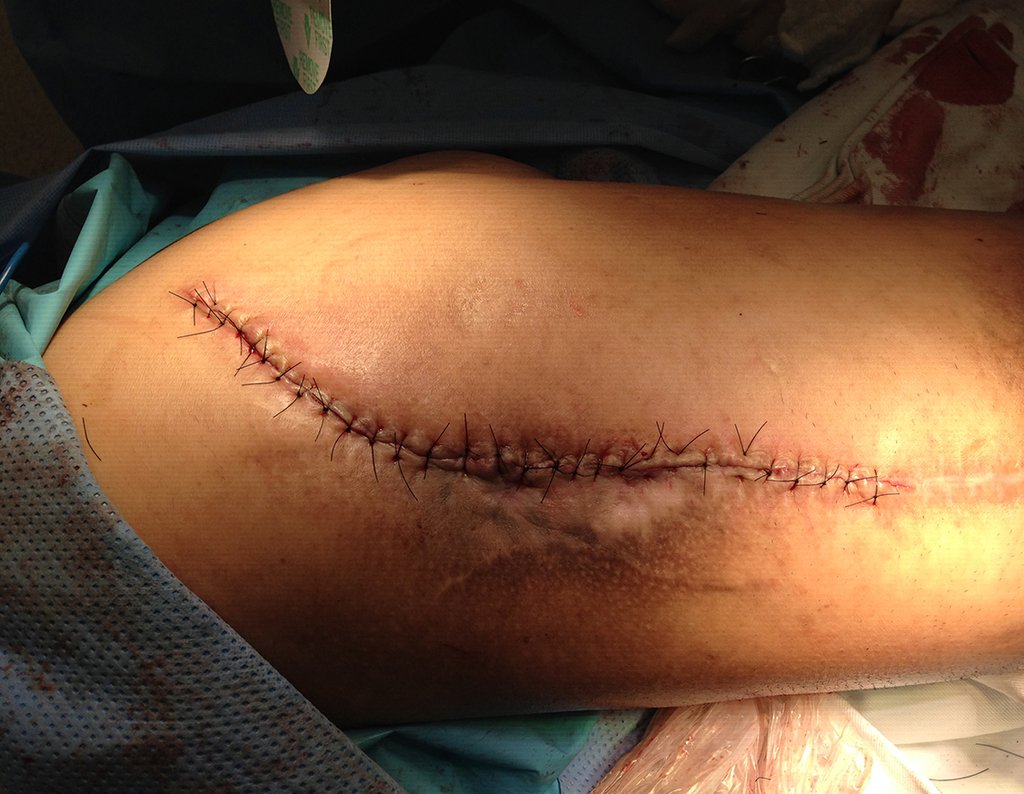
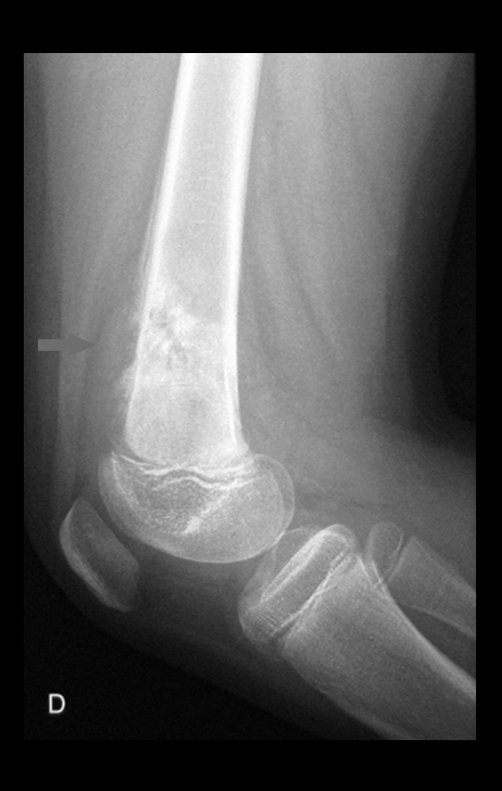
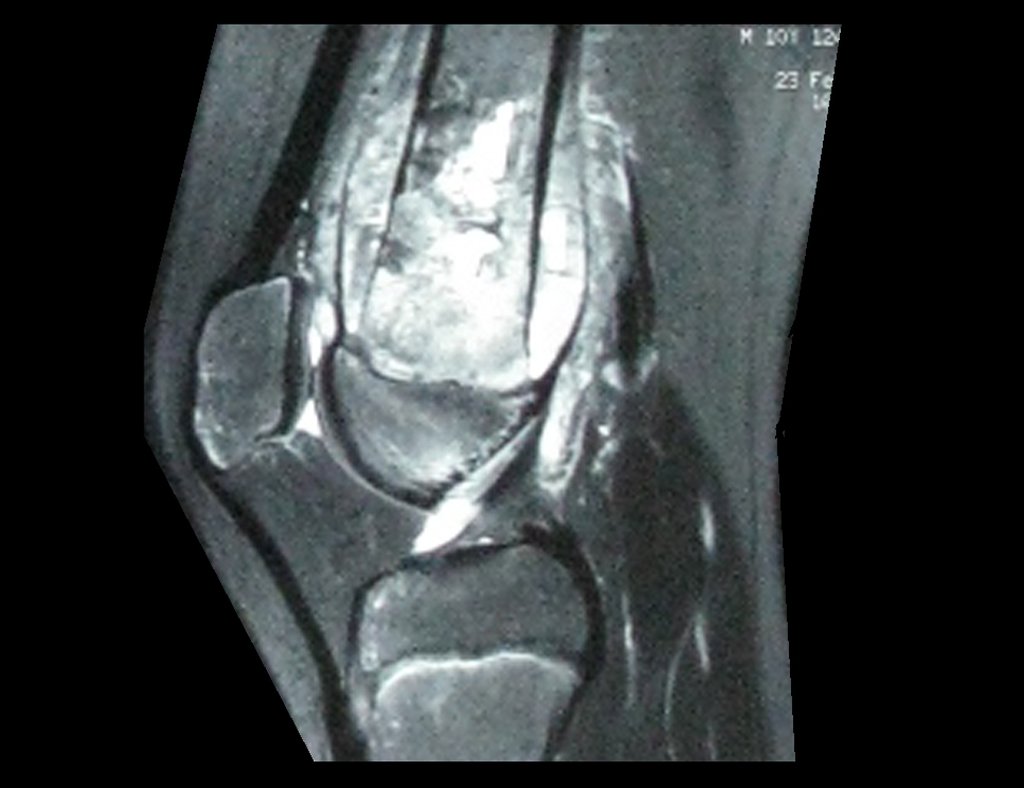
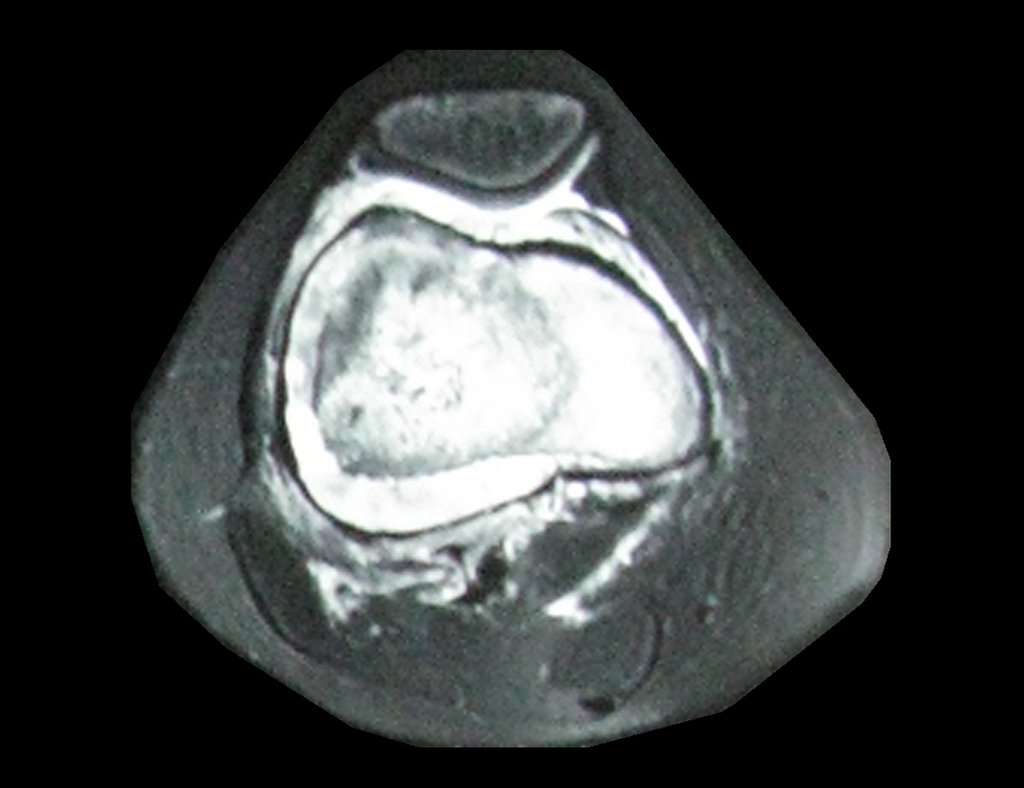
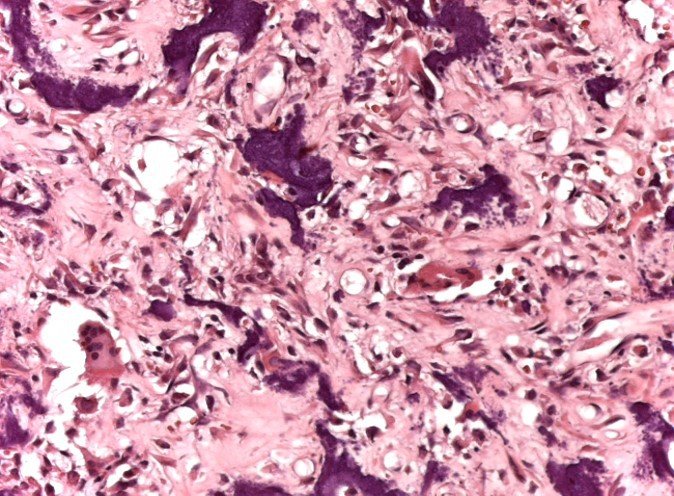
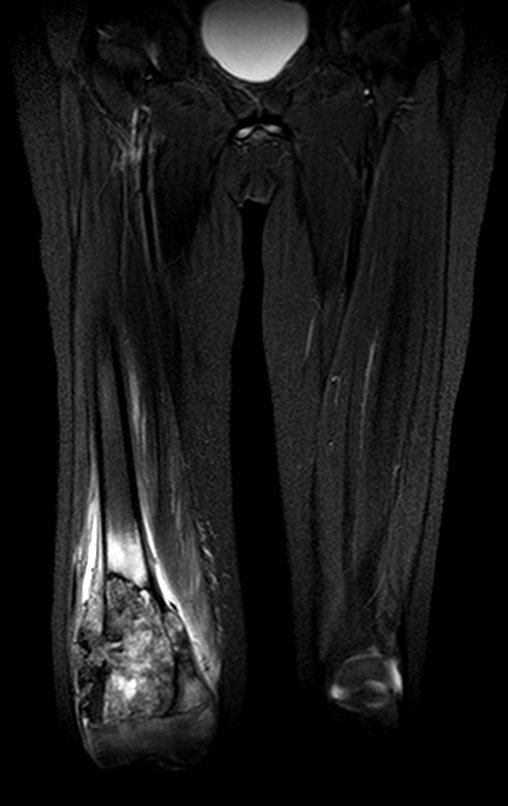
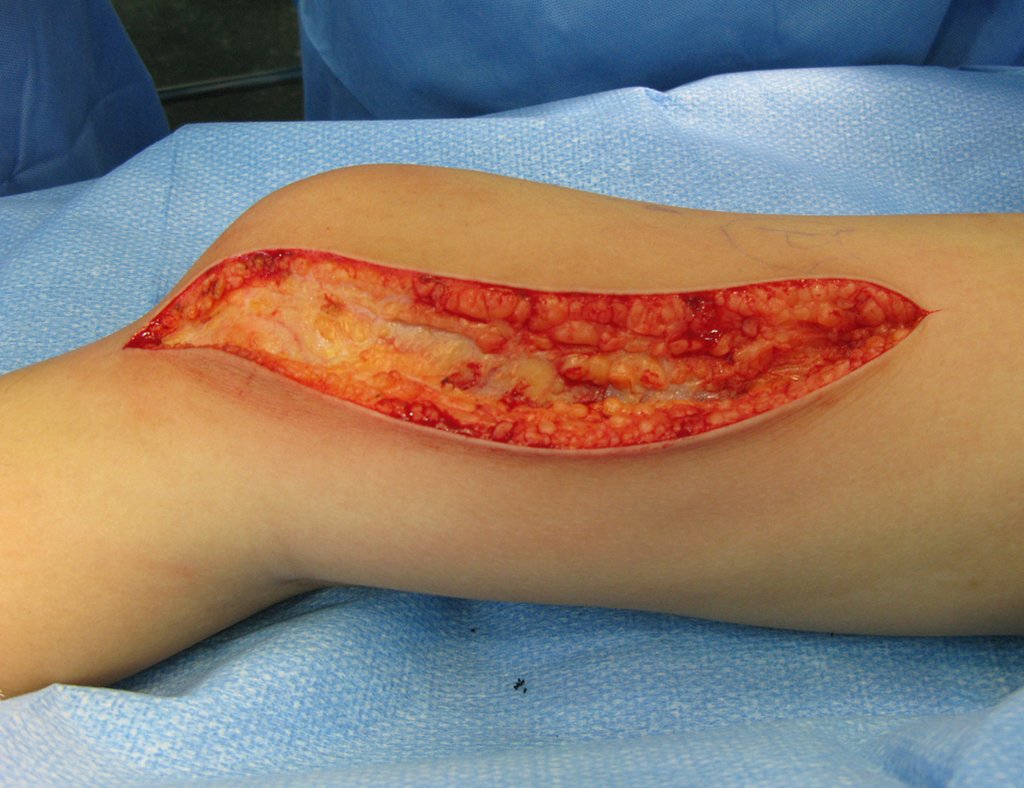
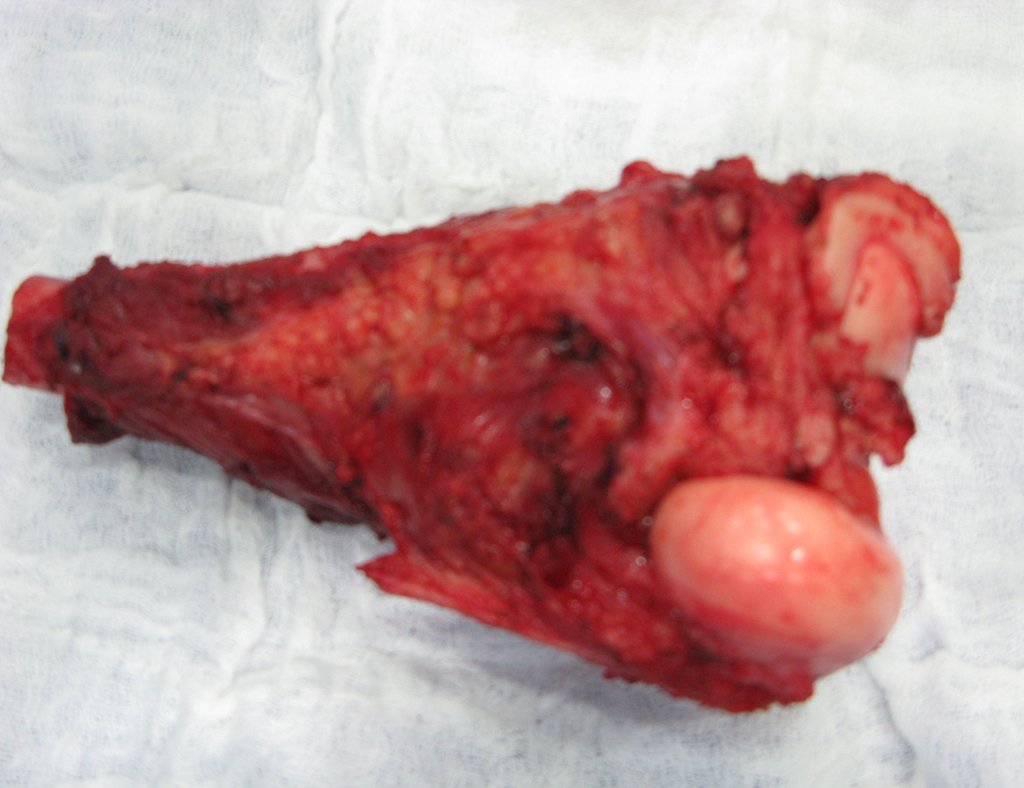
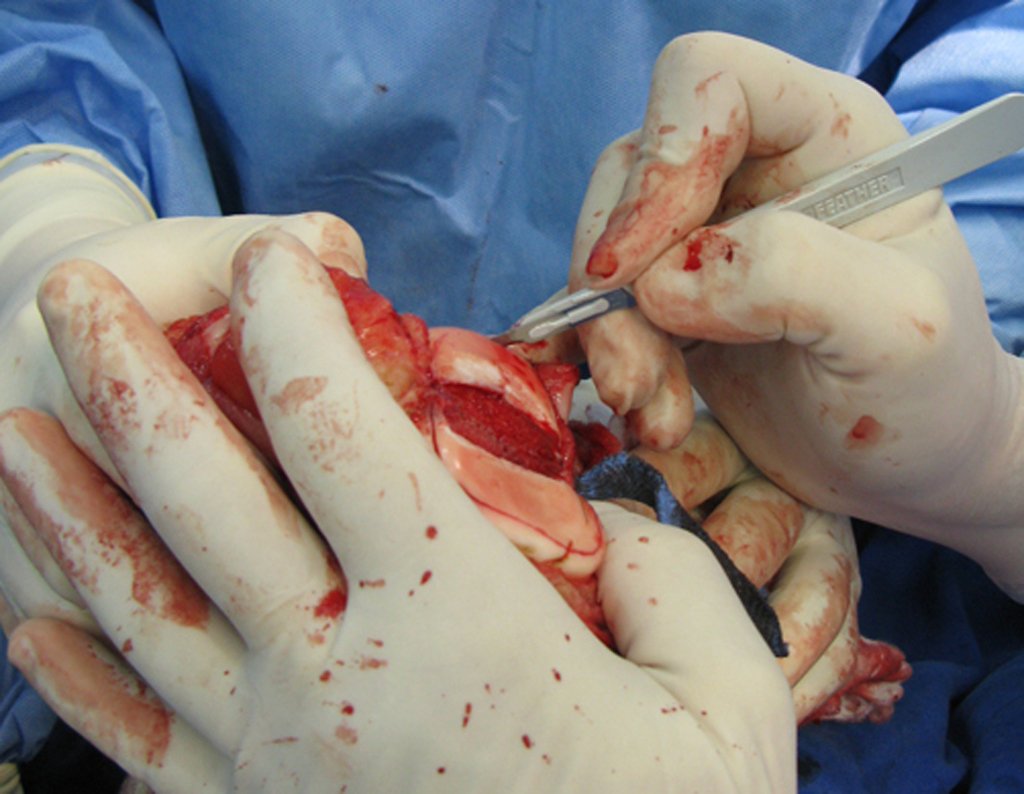
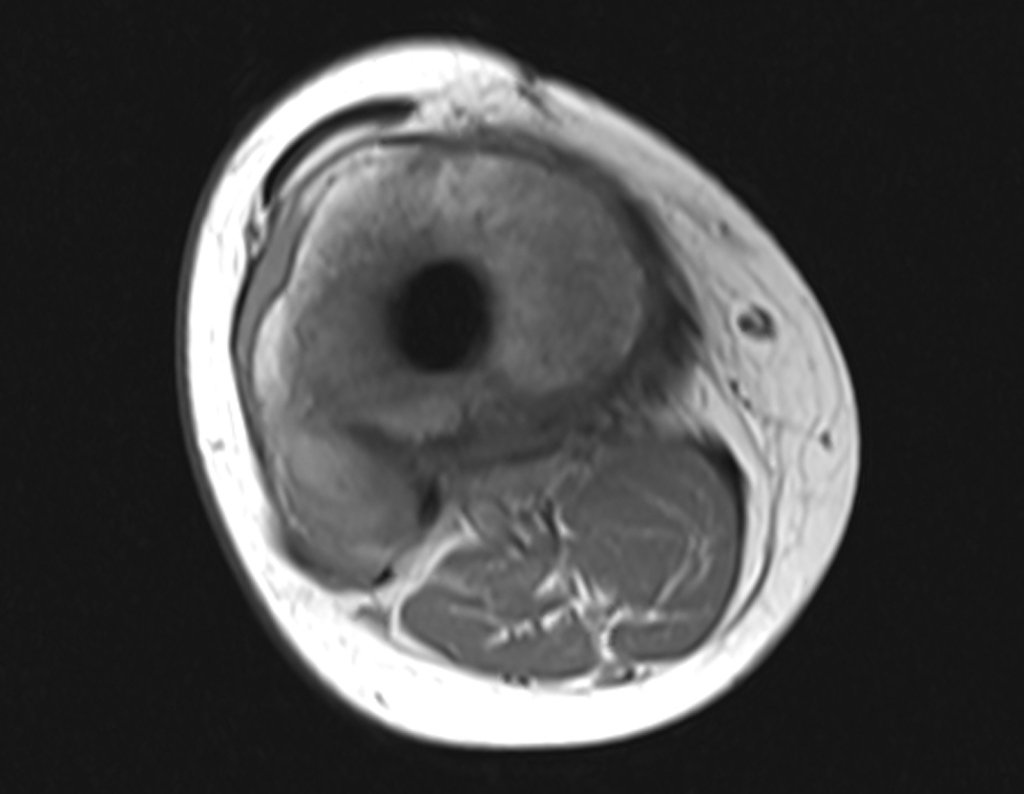
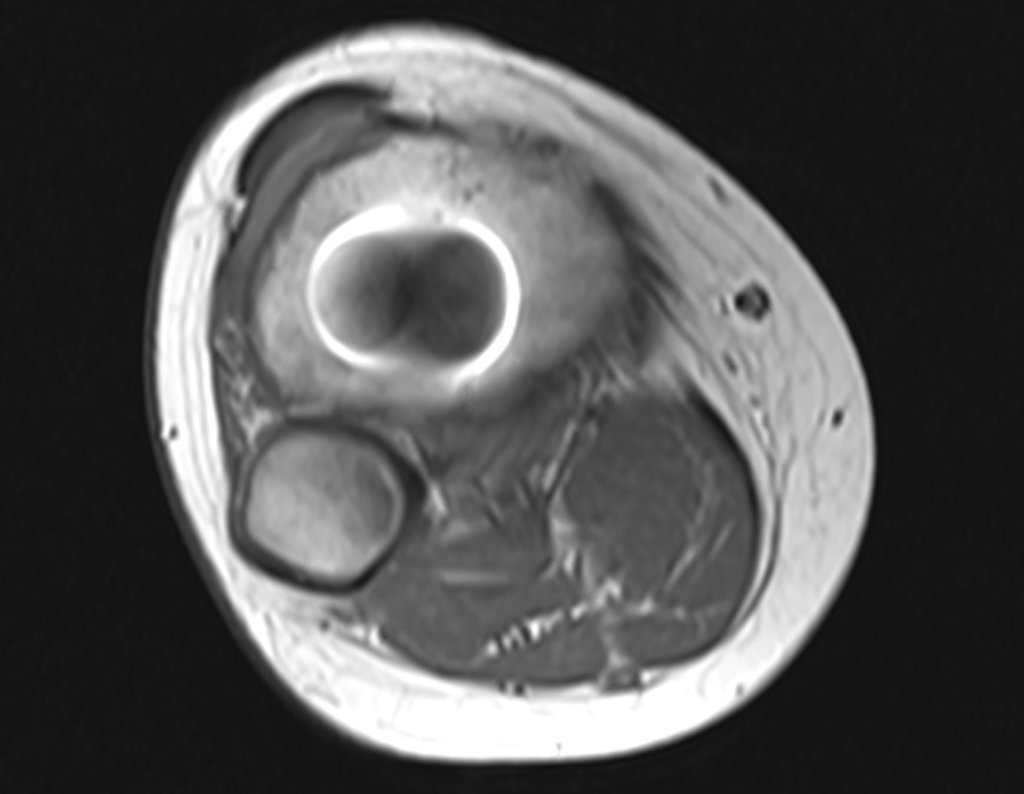
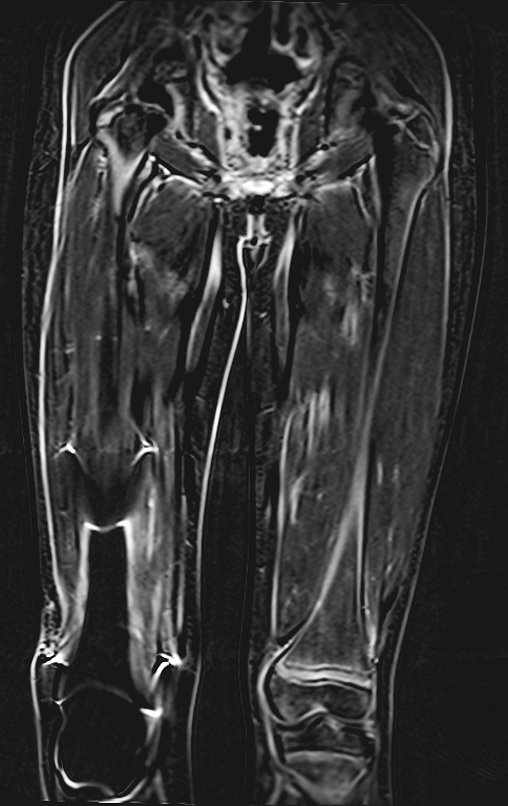
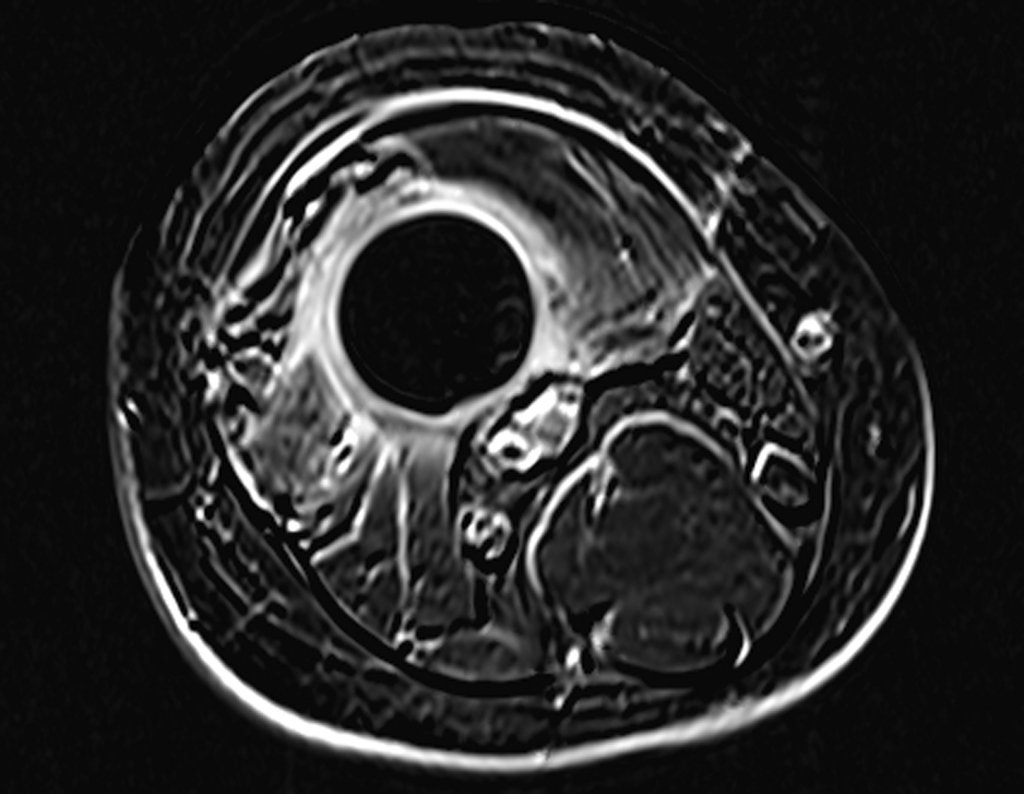
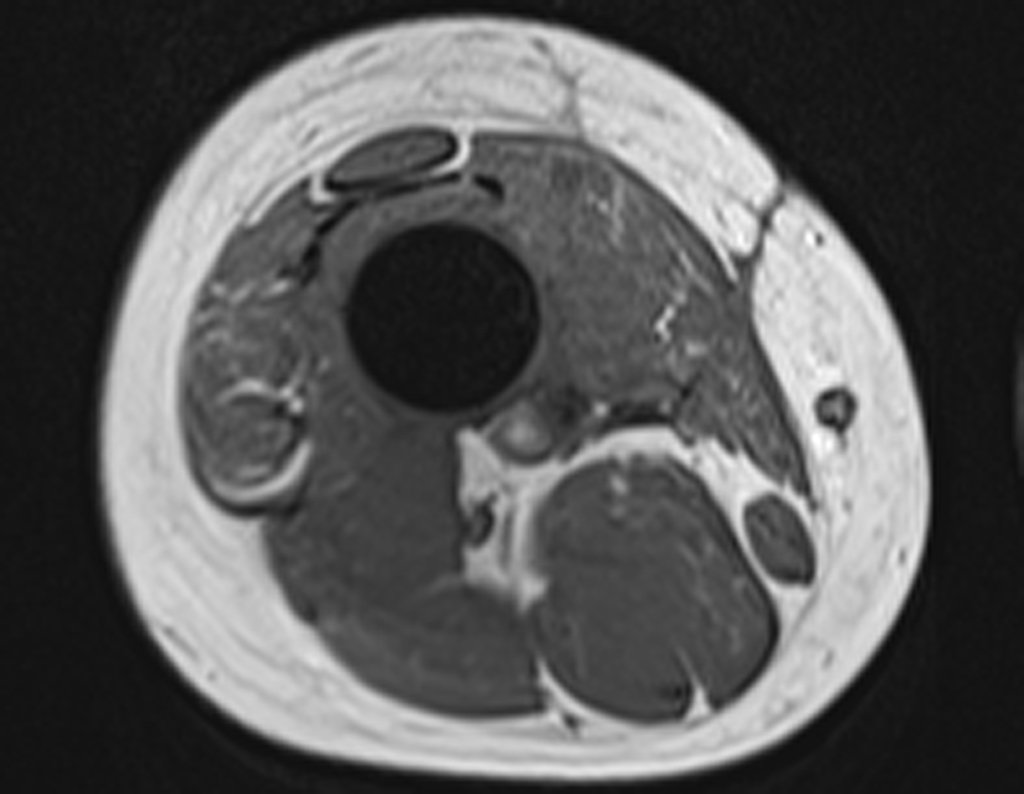
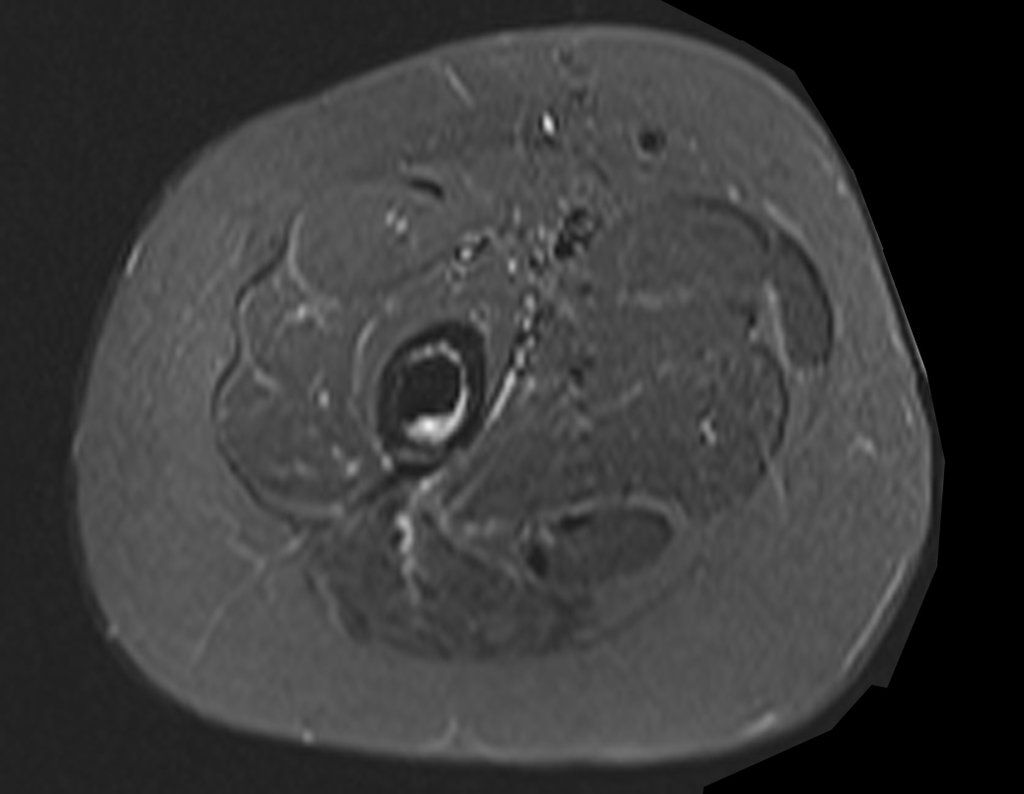
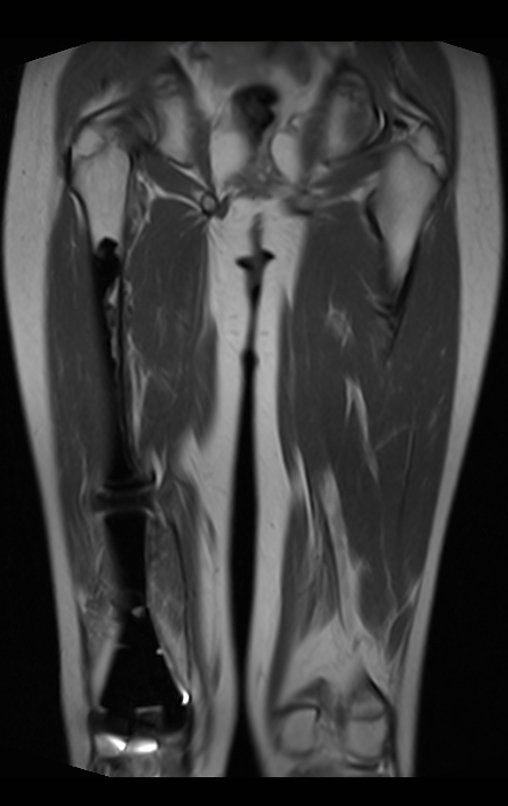
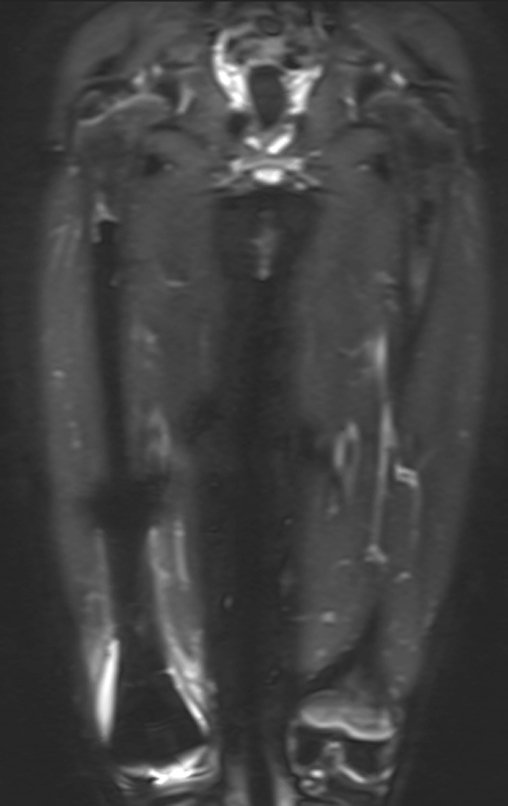
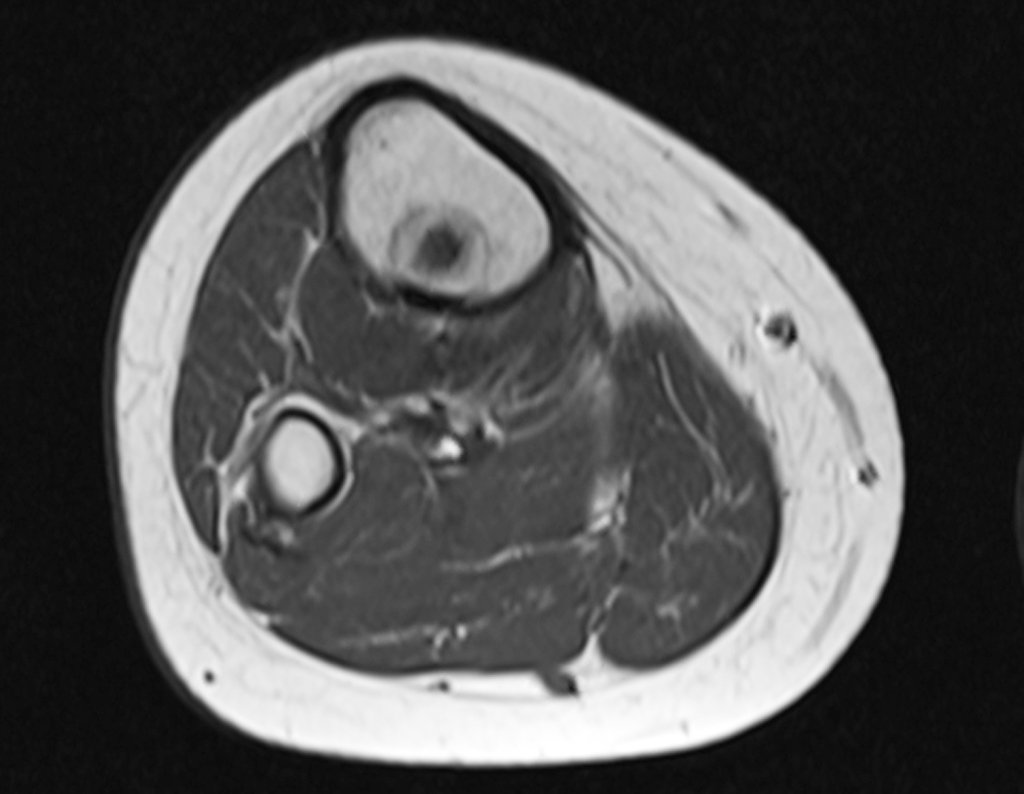
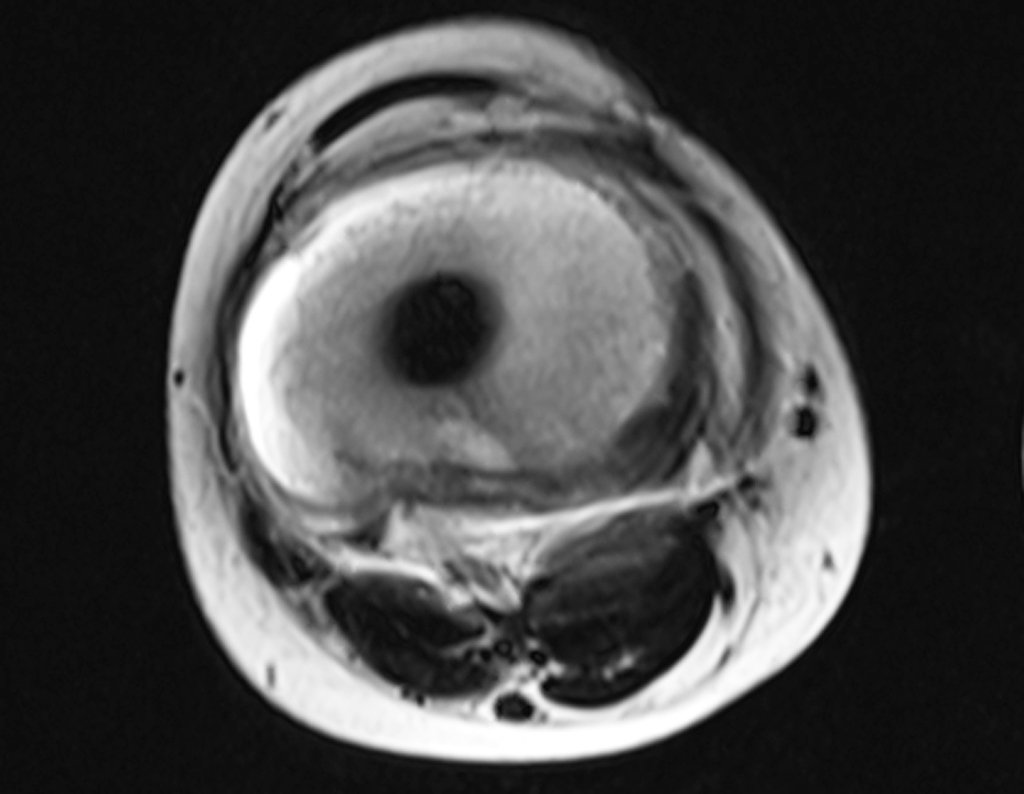
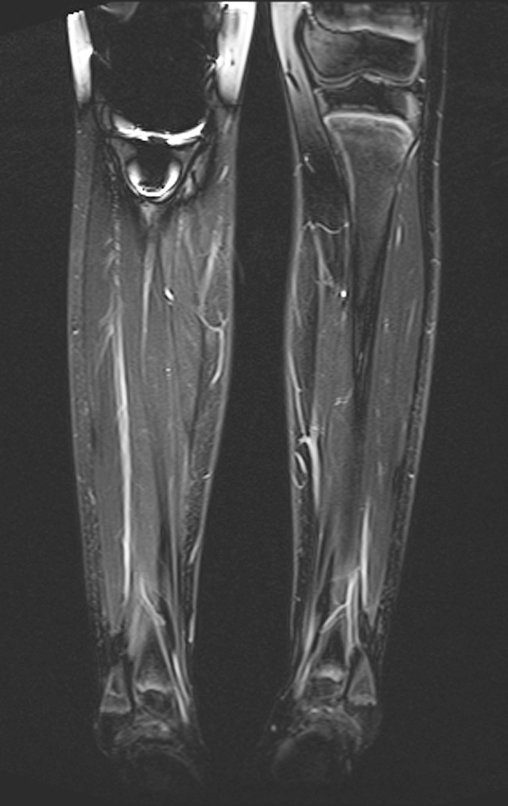
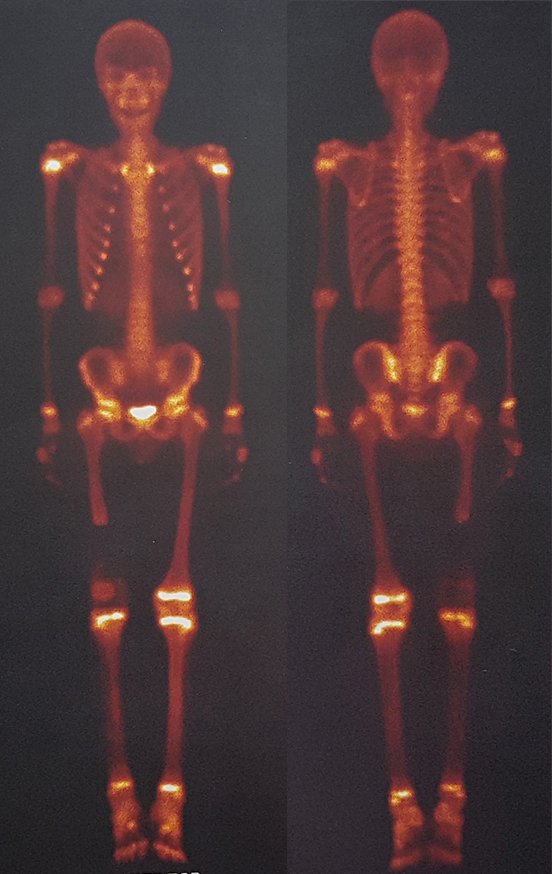
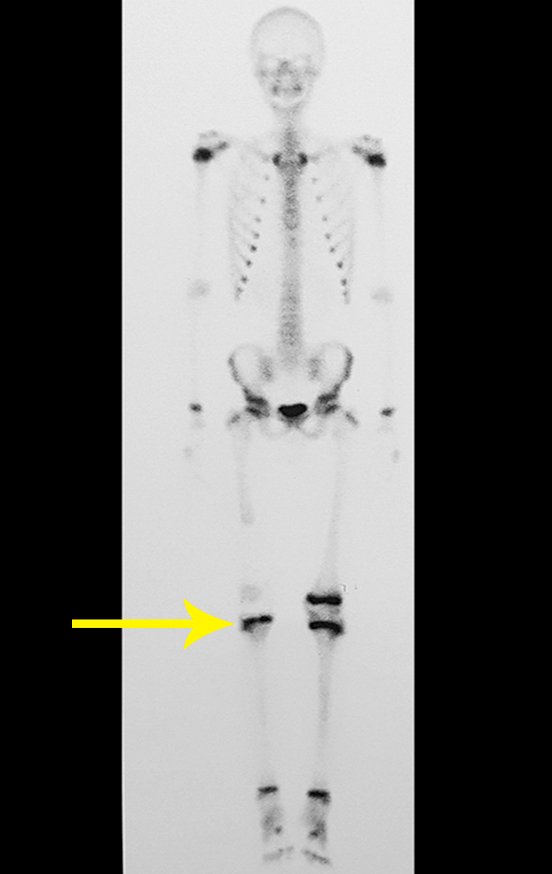
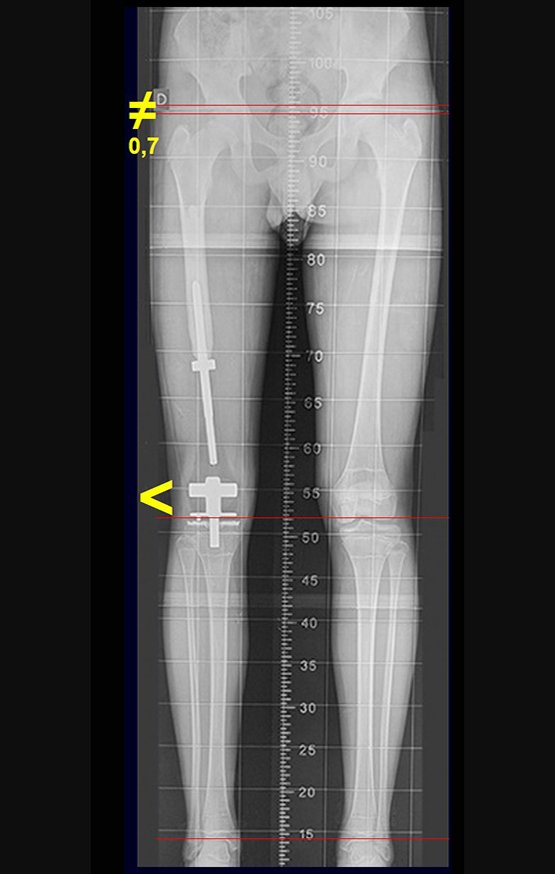
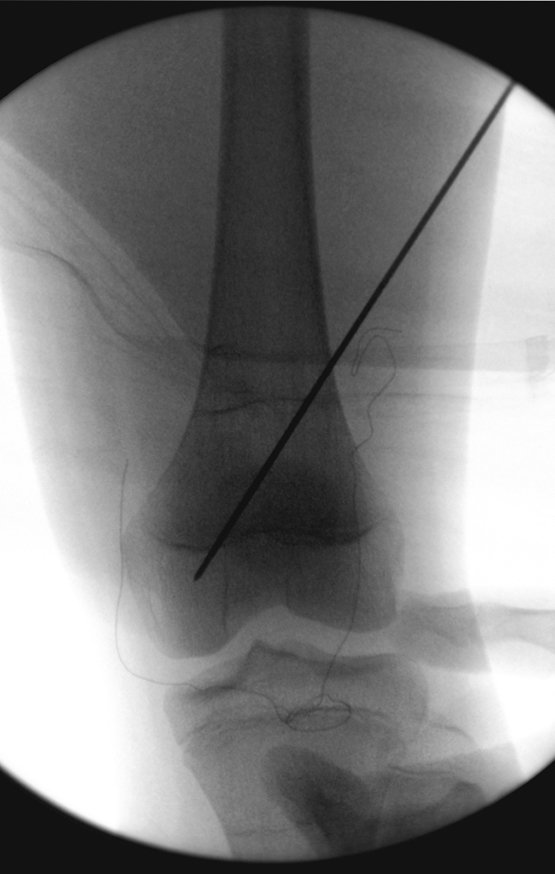
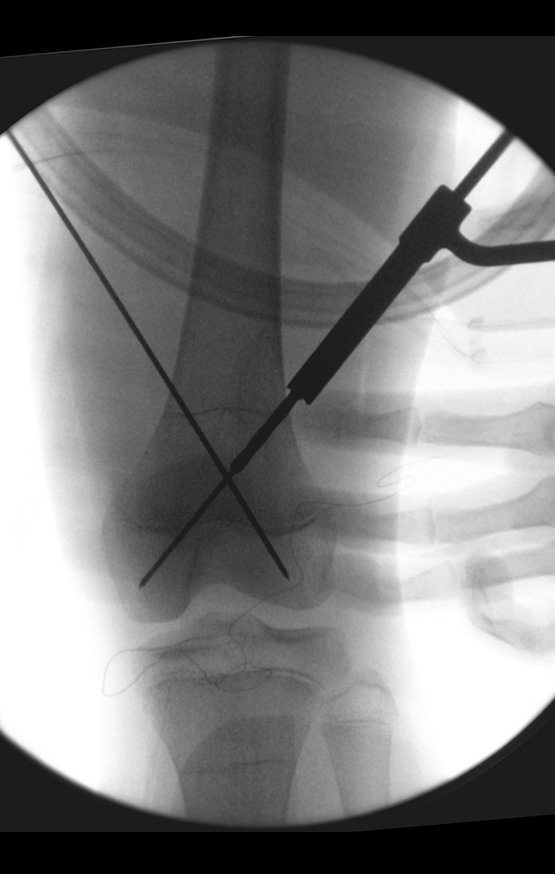
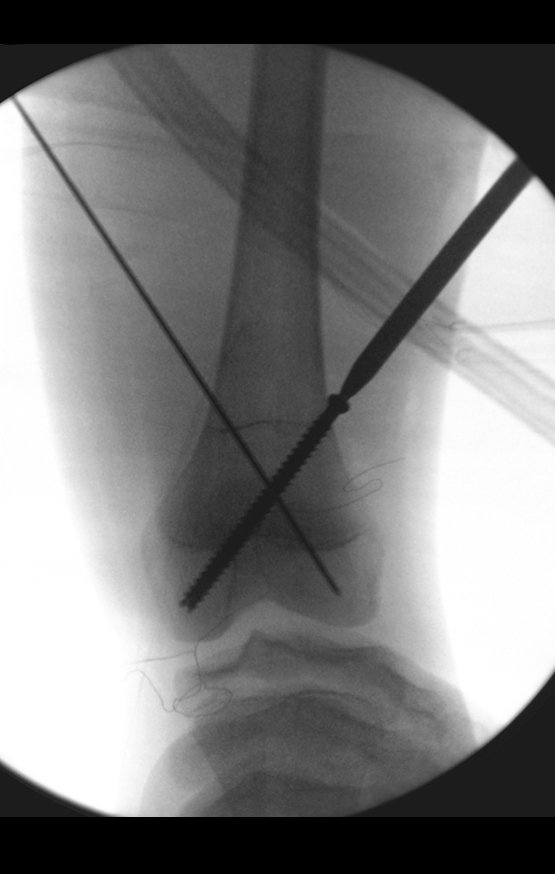
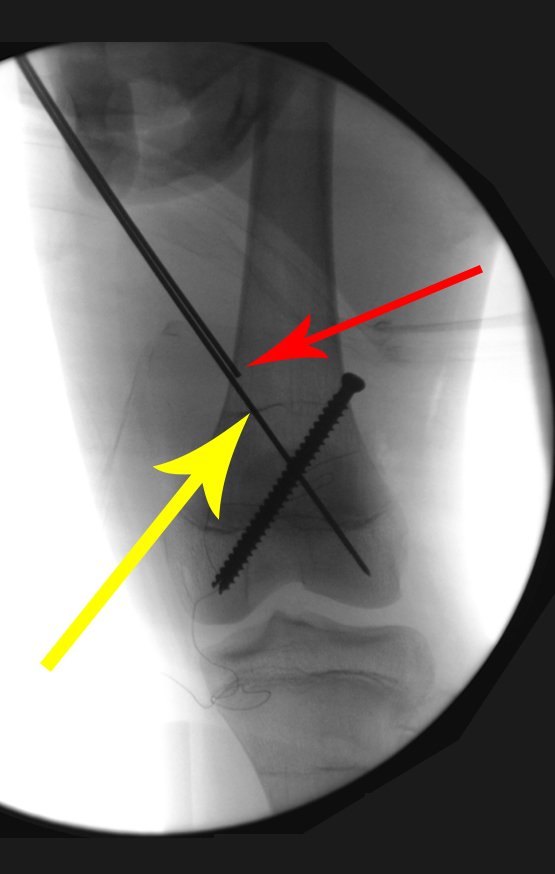
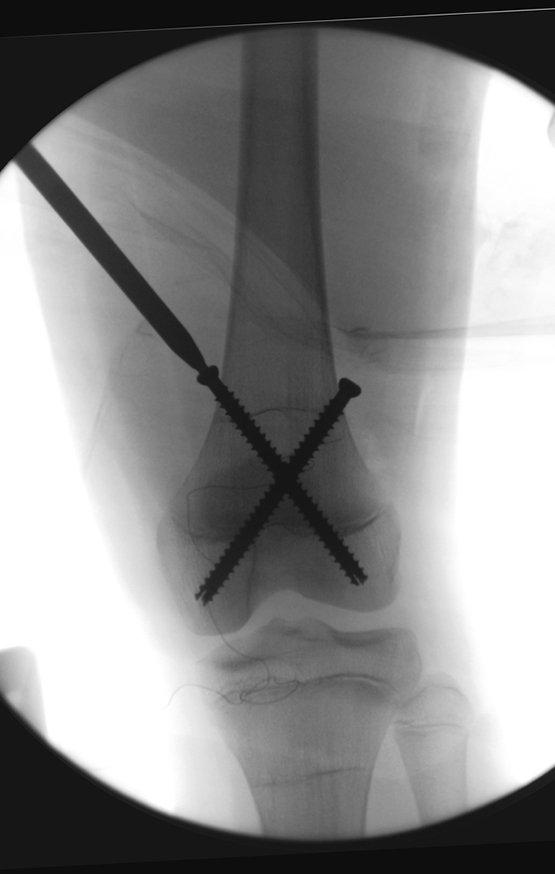
Alguns segmentos ósseos como as extremidades da fíbula, clavícula, costela, terço distal da ulna, proximal do rádio, etc podem ser reessecados, sem a necessidade de reconstrução.
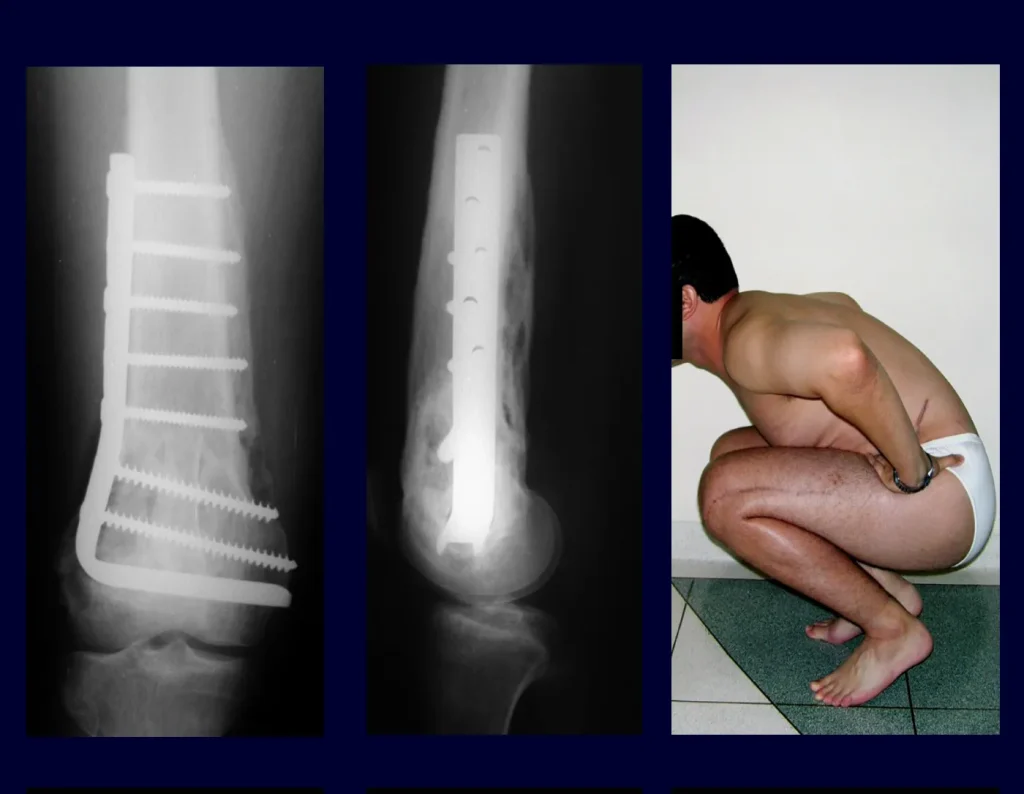
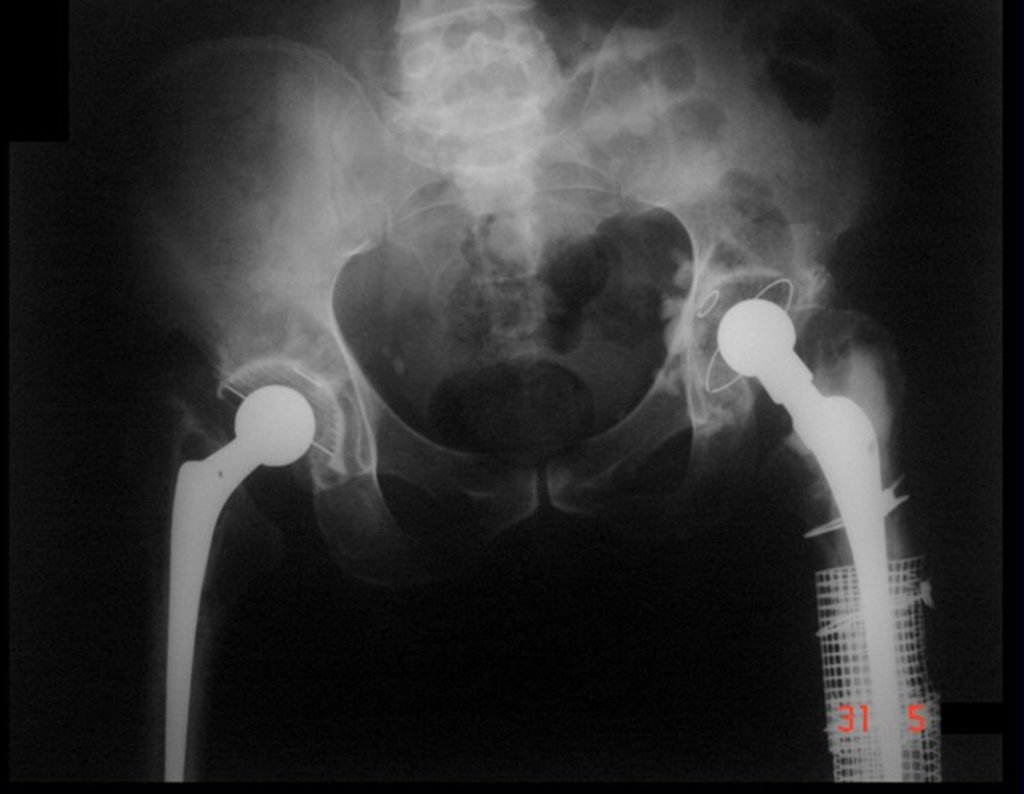
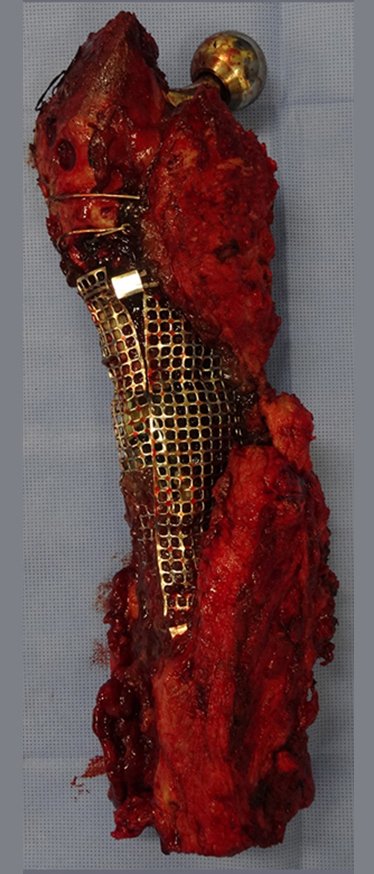
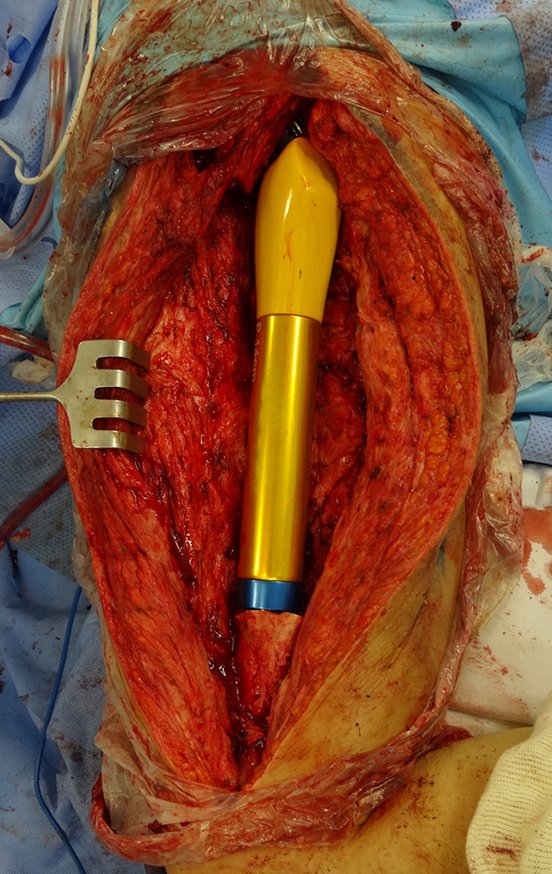
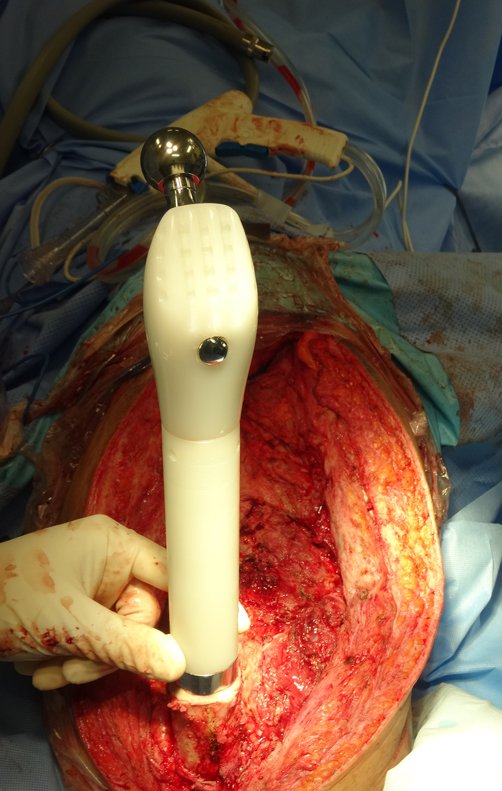
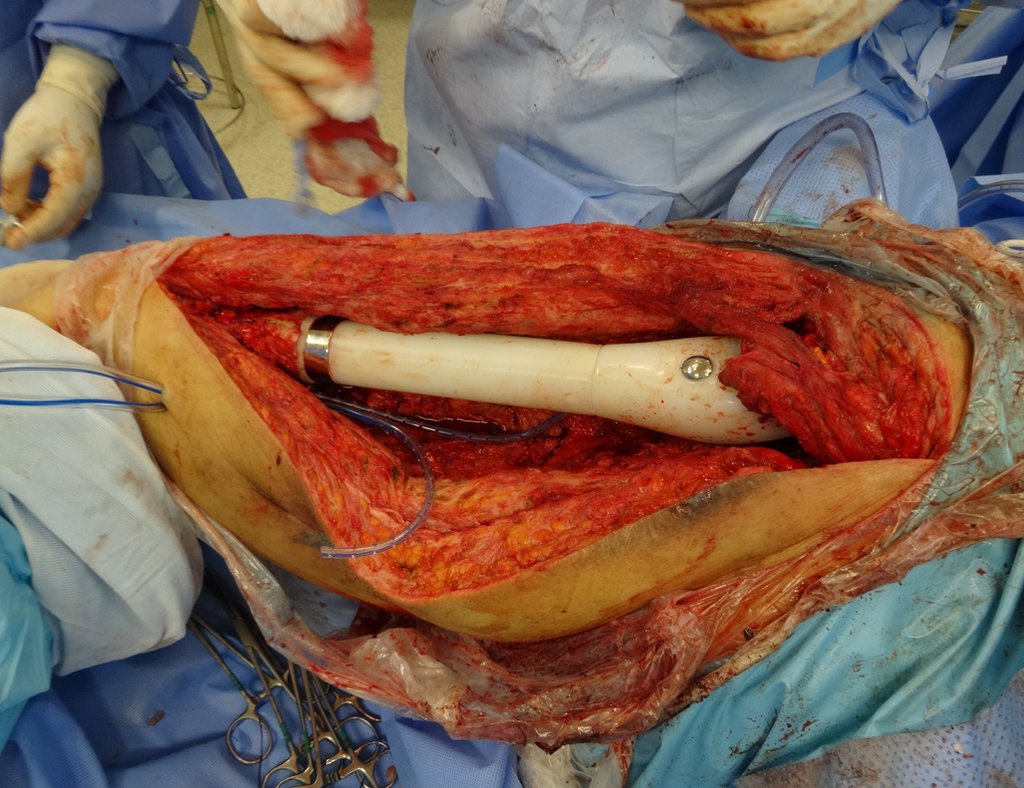
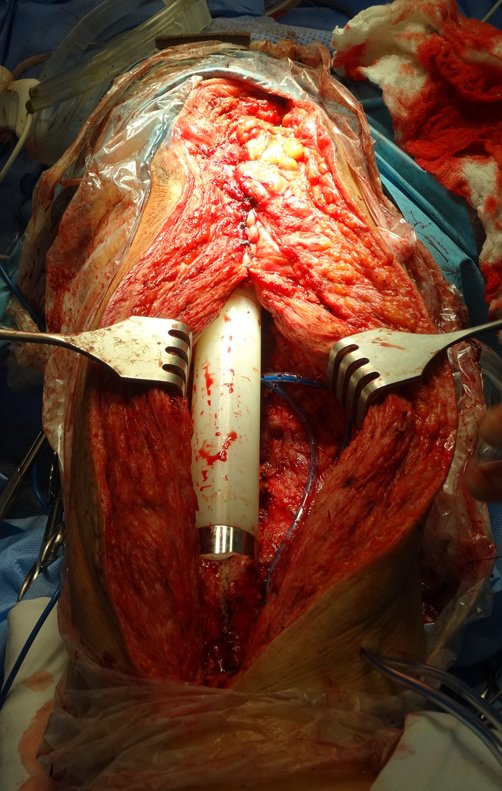
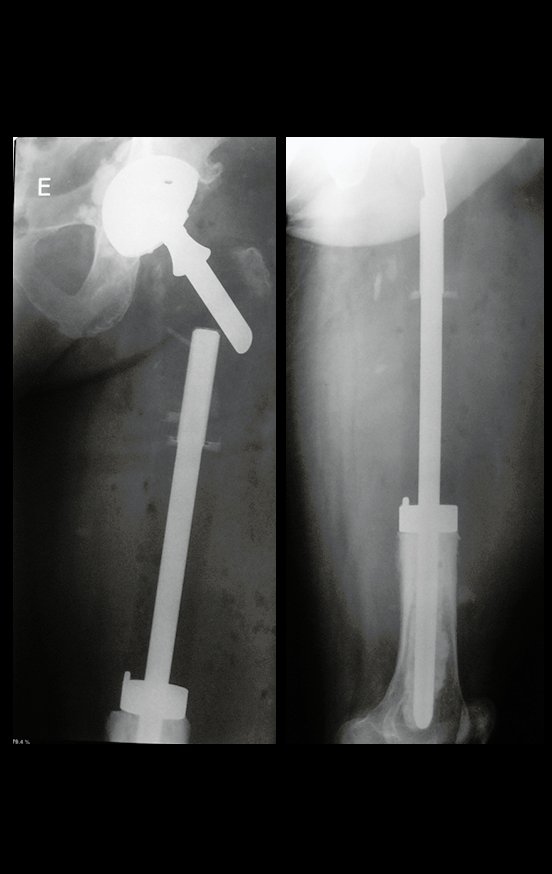
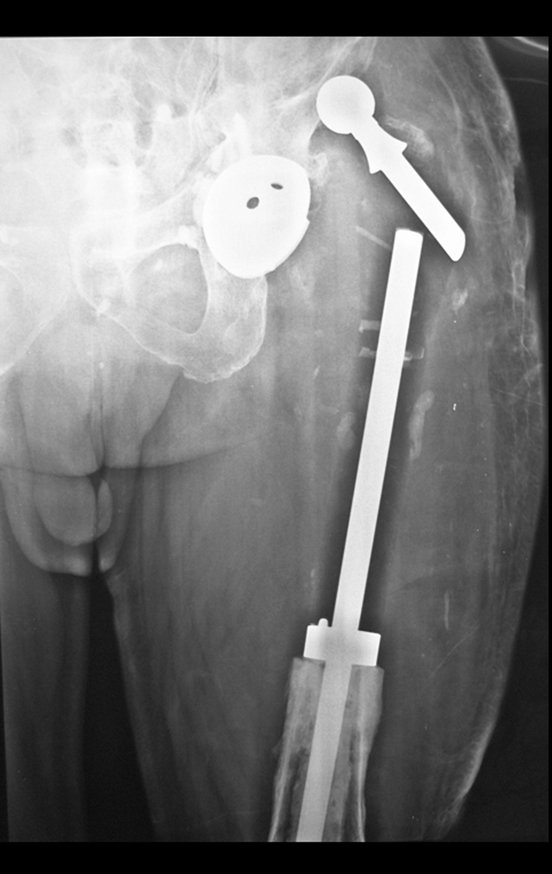
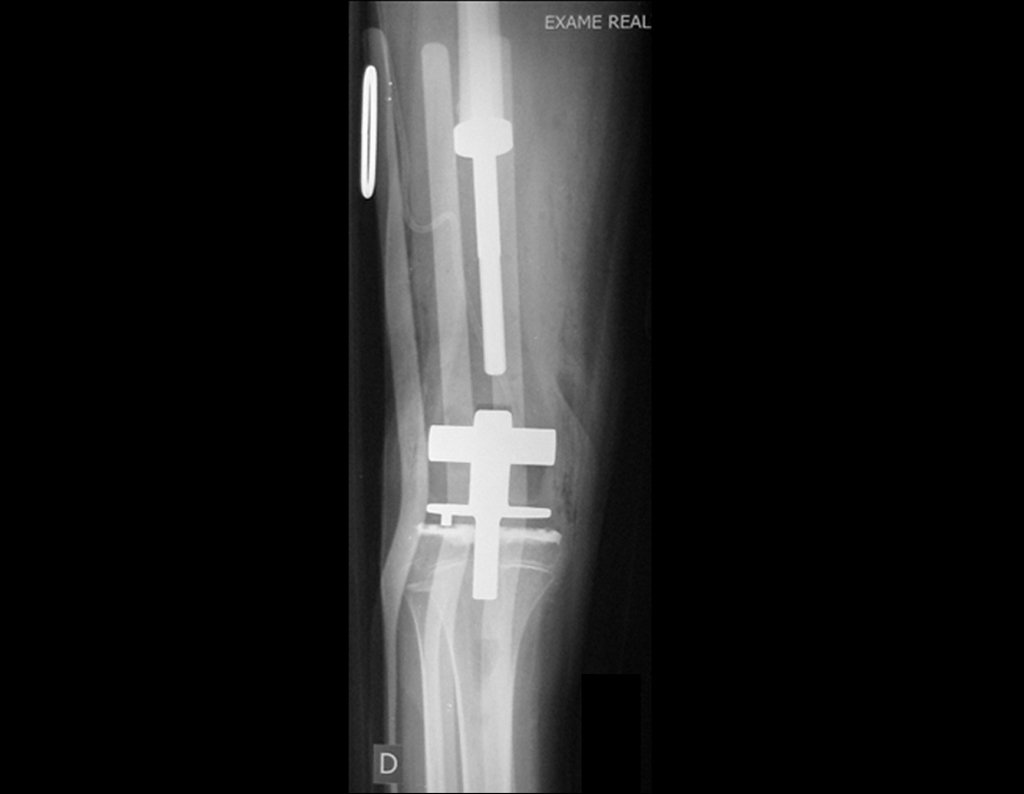
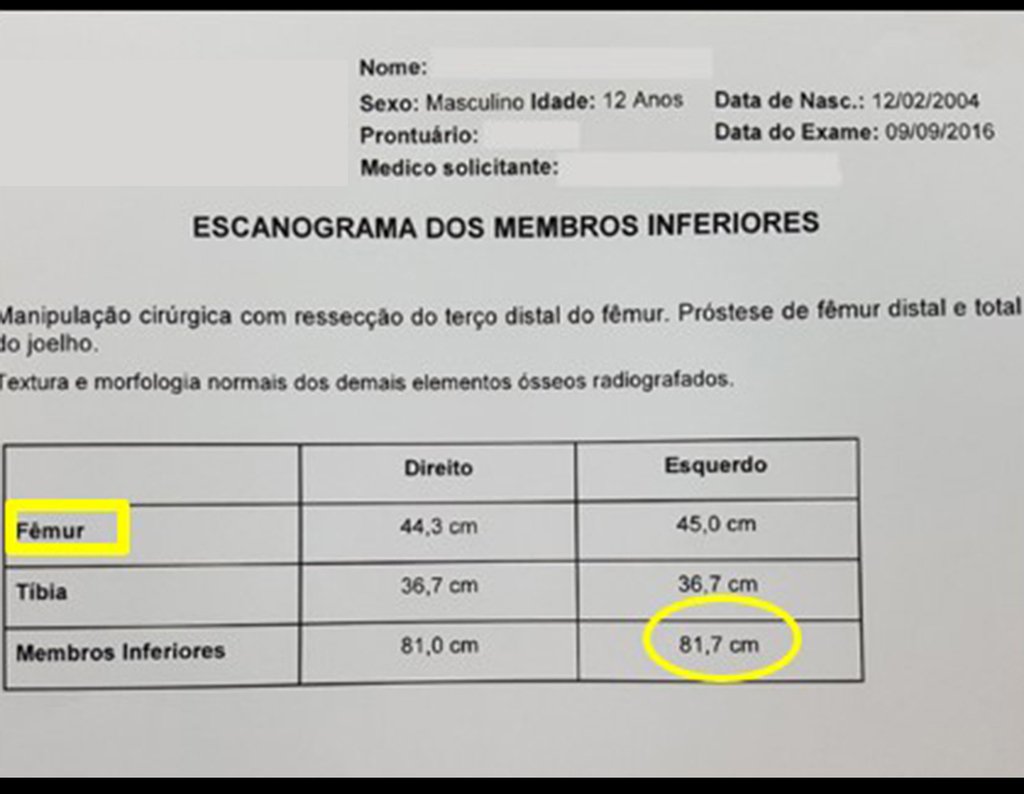
Em outras situações poderemos necessitar de reconstruções segmentares com enxerto ósseo livre ou até mesmo vascularizado ou ainda de reconstruções articulares com próteses nos casos avançados com grande compromentimento articular. Na coluna vertebral, após a ressecção da lesão, pode haver necessidade de artrodese, a fim de evitar instabilidade.
A radioterapia deve ser evitada pelo risco de malignização, entretanto tem sua indicação reservada no controle evolutivo de lesões de difícil acesso, como a coluna cervical por exemplo, ou outras situações em que a reintervenção cirúrgica não é recomendada.
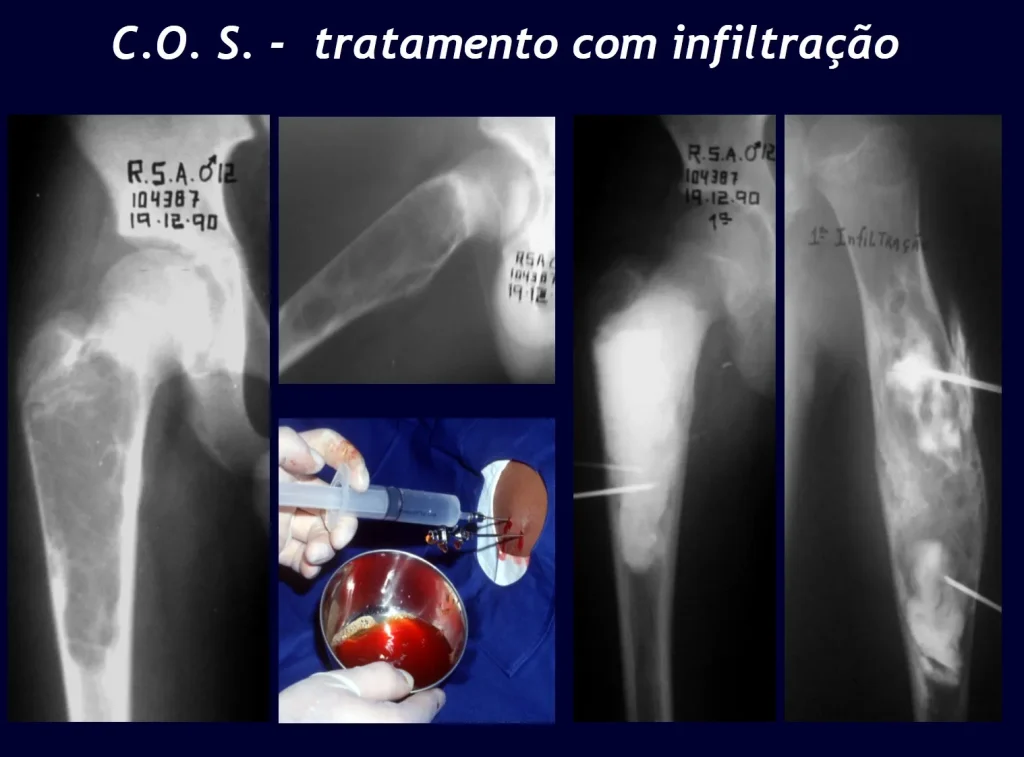
A embolização como terapia isolada é controversa. Pode entretanto ser empregada pré-operatóriamente visando minimizar o sangramento durante a cirurgia. Esta prática é mais utilizada em casos de difícil acesso, embora sua eficácia nem sempre é obtida. A infiltração com calcitonina tem sido relatada com resultado satisfatório em casos isolados.
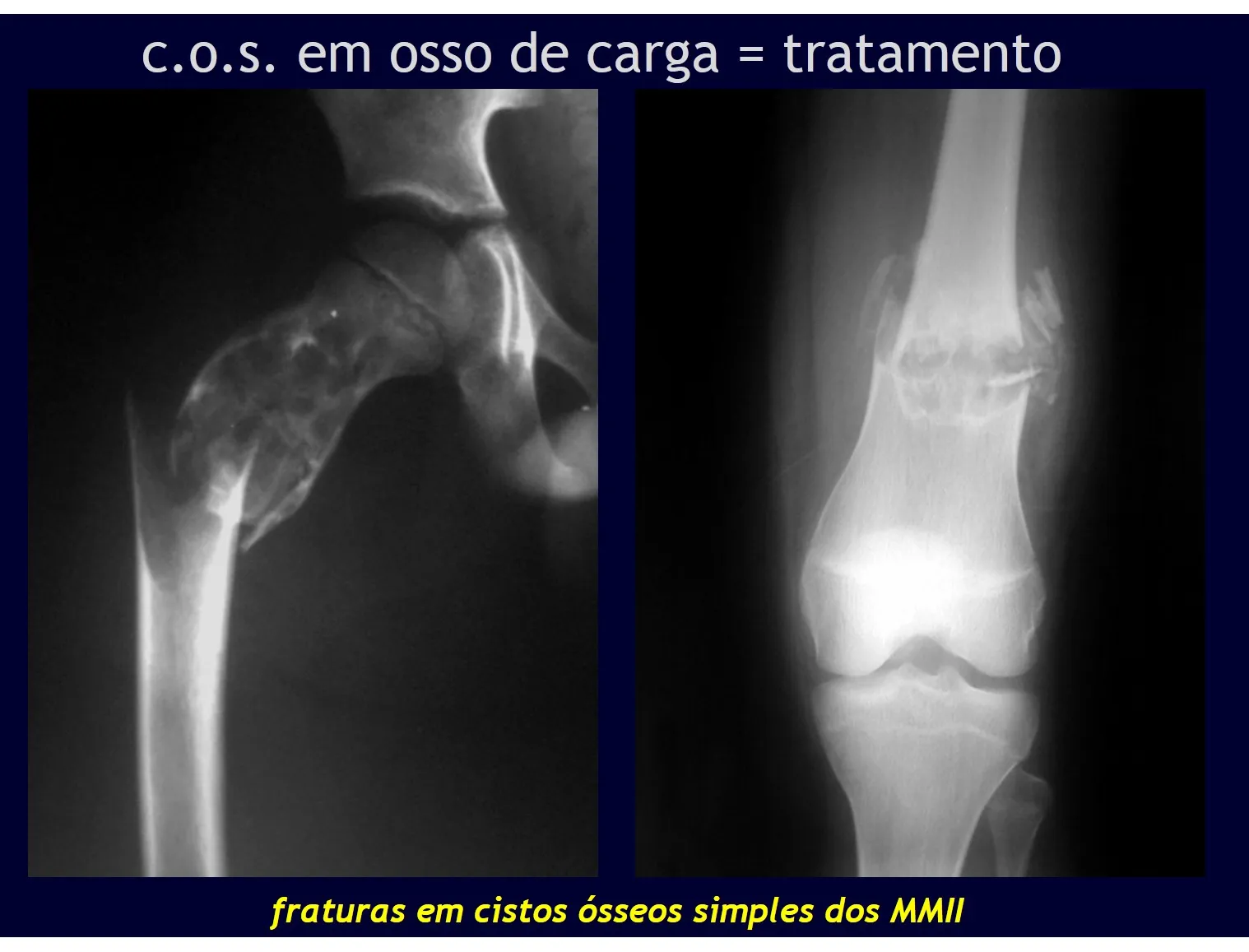
A recidiva pode ocorrer, pois o fenômeno que originou o cisto é desconhecido e não podemos assegurar que a cirurgia o reparou. O índice de recorrencia pode atingir trinta por cento dos casos.
Questões:
1- O cisto ósseo aneurismático:
a- é uma lesão tumoral
b- é uma lesão mestastática
c- ocorre isoladamente ou acompanha outras lesões ósseas
d- é um pseudo-aneurisma
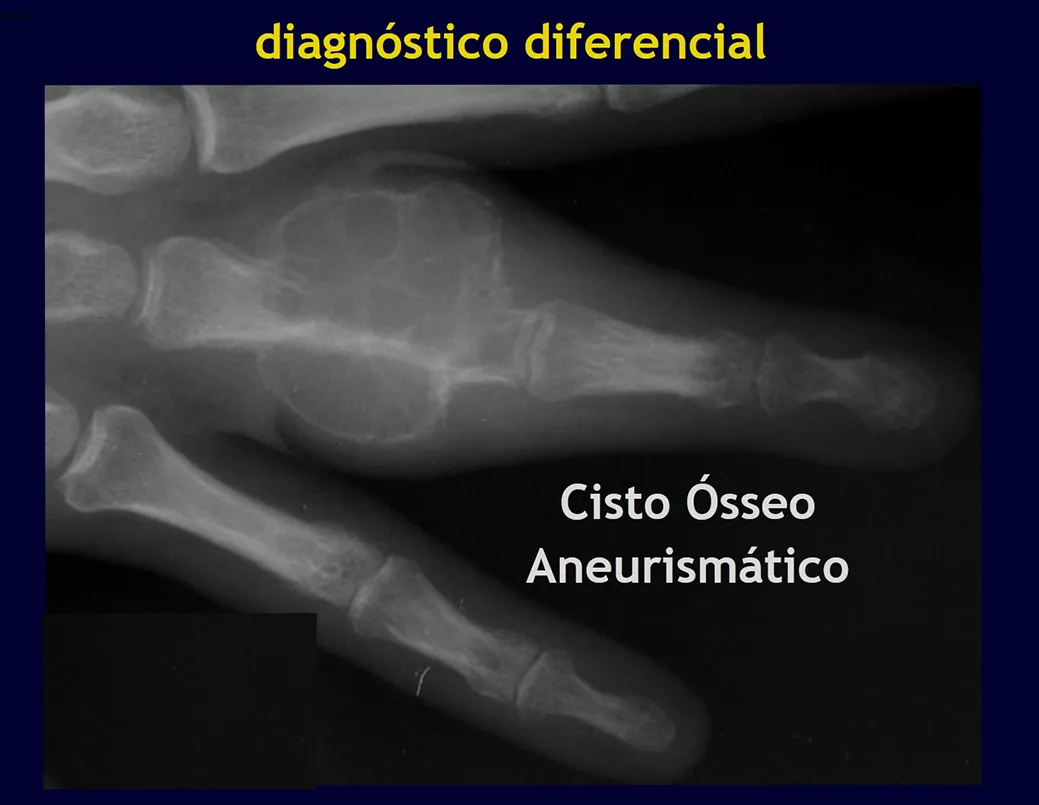
2- Dentre os diagnósticos diferenciais do COA inclui-se:
a- Condrossarcoma
b- TGC
c- Sarcoma de Ewing
d- defeito fibroso cortical
3- Segundo a classificação de Enneking o COA é:
a- lesão benigna ativa
b- lesão benigna latente
c- lesão maligna de baixo grau
d- lesão maligna de alto grau
4- Em relação ao COA é correto afirmar:
a- ocorre mais frequentemente no paciente idoso
b- apresenta células gigantes do tipo osteoclastos
c- deve preferencialmente ser tratado com ressecção ampla
d- apresenta focos de calcificação
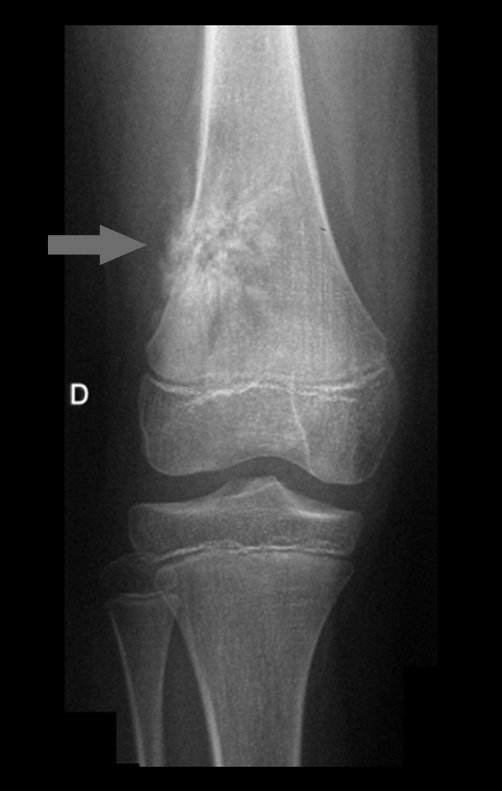
5- O aspecto radiográfico do COA é:
a- lesão óssea condensante
b- lesão óssea heterogênia
c- lesão de rarefação óssea homogênia
d- lesão óssea sem limites precisos.
6- O tratamento preferencial do COA é:
a- curetagem intralesional
b- ressecção segmentar
c- ressecção segmentar + endoprótese
d- Artrodese
7- As lesões tumorais que mais freqüentemente apresentam áreas de cisto ósseo aneurismático são:
a- tgc; condrossarcoma; osteossarcoma e sarcoma de Ewing
b- defeito fibroso; tgc; adamantinoma e cordoma
c- osteoblastoma; condroblastoma; fibroma condromixóide e tgc;
d- osteossarcoma; condroblastoma; granuloma eosinófilo e lipoma
Bibliografia
- ALEOTTI, A.; CERVELLATTI, A.A.;BOVOLENTA, M.R.;ZAGOS,S. Et al Birbeck granules : contribution to the comprehension of intracytoplasmatic evolution. L.Submicrosc. Cytol. Pathol.,30(2):295, 1998.
- AVANZI, O.;JOILDA. F.G.;SALOMÃO, J.C.;PROSPERO, J.D. Cisto ósseo aneurismático na coluna vertebral . Rev. Brás. Ortop., 31:103,1996
- AVANZI, O.;JOILDA. F.G.;PROSPERO , J.D.;CARVALHO PIN TO, W. Tumores benignos e lesões pseudotumorais na colina vertebral . Rev. Brás. Ortop.,31:131,1996.
- BIESECKER, J.L.;HUVOS,A.G .;MIKÉ. V. Aneurisma boné cysts.A clinicopathologic study of 66 cases, Câncer , 26:615,1970
- BURACZEWSKI, J.;M Pathogenesis of aneurismal boné cyst. Ralationship between the aneurismal boné cyst and fibrous displasia of boné . Câncer , 28:116,1971.
- C.D.M. Fletcher…[et al] . Classification of tumor. Pathology and genetics of tumours of solf tissue and bone. World Health Organization
- DABSKA, M,;BURACZEWSKI, J.- Aneurismal boné cyst . Pathology, clinical course and radiologic appearance . Câncer . 23:371,1969.
- DAHLIN, D.C,;IVINS, J.C.- Benignin chondroblastoma of boné . A clinicopathology and electron microscopc study . Câncer .29:760,1972.
- DAILEY , R .; GILLILAUD, C.;McCOY, G.B. Orbital aneuriysmal boné cyst in a patient with renal carcinoma . Am. J . Ophtalm., 117:643, 1944.
- DORFMAN ,H.D.;CZERBIAK,B.Bone tumors. St. Louis,C.V.Mosby Co.,1997. P 855.
- DORFMAN ,H.D.; STEINER, G.C.;JAFFE, H.L. Vascular tumors of thr boné . Hum. Pathol.,2:349, 1971.
- JAFFE, H.L.;LICHTENSTEIN, L . Aneurismal boné cyst :obeservation on fifty cases . J.Bone Join Surg.,39 A :873, 1957.
- JAFFE, H.L.;LICHTENSTEIN, L .Benign chondroblastoma of boné . A reinterpretation of the so called calcifying or chondronaous giant cell tumor. Am J. .,18:969, 1942.
- JAFFE,H . L. Aneurismal boné cyst.Bull. Hosp. J .Dis.,11:3,1950.
- LICHTENSTEIN, L Aneurysmal boné cyst. A pathological entity commonly mistaken for giant cell tumor and occasionally for hemangioma sarcoma. Câncer, 3:279,1954.
- MARTINEZ, V.;SISSONS.H.A. Aneurysmal boné cyst.A review of 123 cases including primary lesions and those secondary to other boné pathoogy. Câncer,61:2291 , 1988.
- PROSPERO, J.D.;RIBEIRO BAPTISTA , P.P.;de Lima Jr., H. Doenças ósseas com células gigantes multinucleadas. Diagnostico diferencial. Rev. Brás. Ortop.,34:214,1999.
- RIUTTER,D.J,;VAN RUSSEL, T.H.G.;VANder VELDE, E.A. Aneuryamal boné cyst. A clinicopathological study of 105 cases. Câncer. 39:2231,1977.
- SCHAJOWICZ,F. Giant cell tumors aneuryamal boné cyst of the spine. J .Bone Joint Surg.,47B:699, 1965.