O tumor de células gigantes é neoplasia de natureza mesenquimal, caracterizada pela proliferação de células gigantes multinucleadas (gigantócitos) que se assemelham aos osteoclastos, em meio de estroma de células mononucleadas (fig. 1a). Também é conhecido como osteoclastoma e tumor giganto-celular, sendo corrente o emprego das siglas TCG ou TGC. Foi primeiramente descrito por Sir Astley Cooper(1) em 1818. Posteriormente, Paget (1853)(2) denominou-o “tumor marrom ou mielóide”. Nelaton (1860)(3) descreveu suas características clínicas e histológicas, salientando sua agressividade local e dando-lhe o nome de “tumor a mieloplaxis”. Gross (1879)(4) insistiu sobre sua benignidade e ressaltou as dificuldades de diagnóstico diferencial com “a variante aneurismática do sarcoma medular”. Com o advento da radiologia, apurou-se o diagnóstico diferencial dessa lesão e Bloodgood (1923)(5) propôs a denominação de “tumor benigno de células gigantes”.
Tumor de células gigantes
Nas últimas décadas, muito se tem discutido sobre a natureza do tumor giganto-celular. Para Geschikter e Copeland (1949)(6) e Willis (1949)(7), o tumor giganto-celular seria uma neoplasia de osteoclastos em meio de estroma mesenquimal, dada a semelhança entre o gigantócito e o osteoclasto normal.
Jaffe et al (1940)(8) descreveram sua origem como sendo derivada das células do estroma. Sherman (1965)(9) afirmou que o osso desaparecia no local de crescimento do tumor e os gigantócitos resultariam da fusão das células mesenquimais do estroma, tendo em conta a semelhança entre a microscopia óptica dos núcleos do estroma e das células gigantes. Os trabalhos de histoquímica e cultura de tecidos realizados por Schajowicz (1961)(10) não demonstraram diferenças significativas entre os gigantócitos tumorais e os osteoclastos normais. Por outro lado, estudos utilizando microscopia eletrônica(11) confirmaram que as células gigantes são sincícios constituídos de células do estroma. Assim, as células mesenquimais indiferenciadas da medula óssea dariam origem ao estroma tumoral, cujas células, por sua vez, ao se diferenciarem, formariam aglomerados com as características dos gigantócitos. As numerosas células gigantes que se assemelham aos osteoclastos, em meio de estroma de células fusiformes, são os elementos mais importantes desse tumor. O aspecto histológico do TGC apresenta características comuns a diversas lesões tumorais e pseudotumorais(12,13), sendo necessária a análise conjunta com as características clínicas e de imagem para a confirmação do diagnóstico(14,15).
Empregamos a eletrotermia(33,37,41) como adjuvante local, utilizando-se para isso do bisturi elétrico. Essa técnica de eletrotermia é eficaz, pois com a ponta encurvada do bisturi conseguimos atingir áreas de acesso mais difícil. A eletrotermia, além da cauterização, realiza também uma complementação da curetagem, à medida que as células tumorais, remanescentes nas pequenas “cáries” da parede óssea, são destruídas e vão desprendendo-se, facilitando sua remoção. A eletrotermia deve preceder a fresagem, evitan-do-se possível disseminação das células, devido à rotação do Lentodrill. Na região do joelho (fig. 5) indicamos freqüentemente a curetagem endocavitária, seguida da eletrotermia e fresagem com Lentodrill. Isso porque a ressecção segmentar dessa região implicaria artrodese ou substituição por endoprótese ou enxerto homólogo osteoarticular.
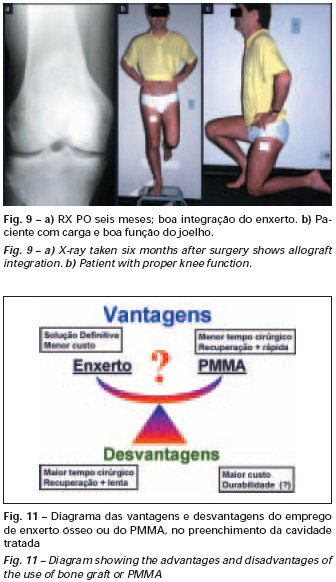
O metilmetacrilato permite visualizar eventuais recidivas com facilidade, é de fácil emprego e permite carga precoce; entretanto, não é solução biológica e podem ocorrer fraturas na região(39).
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com