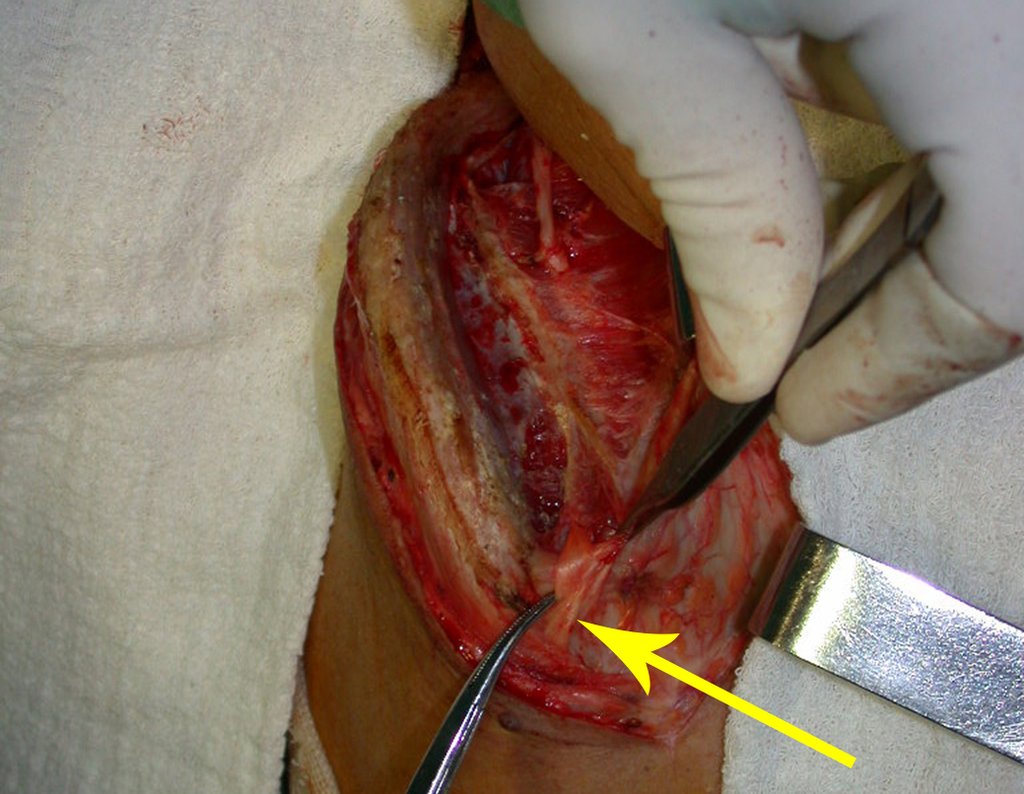
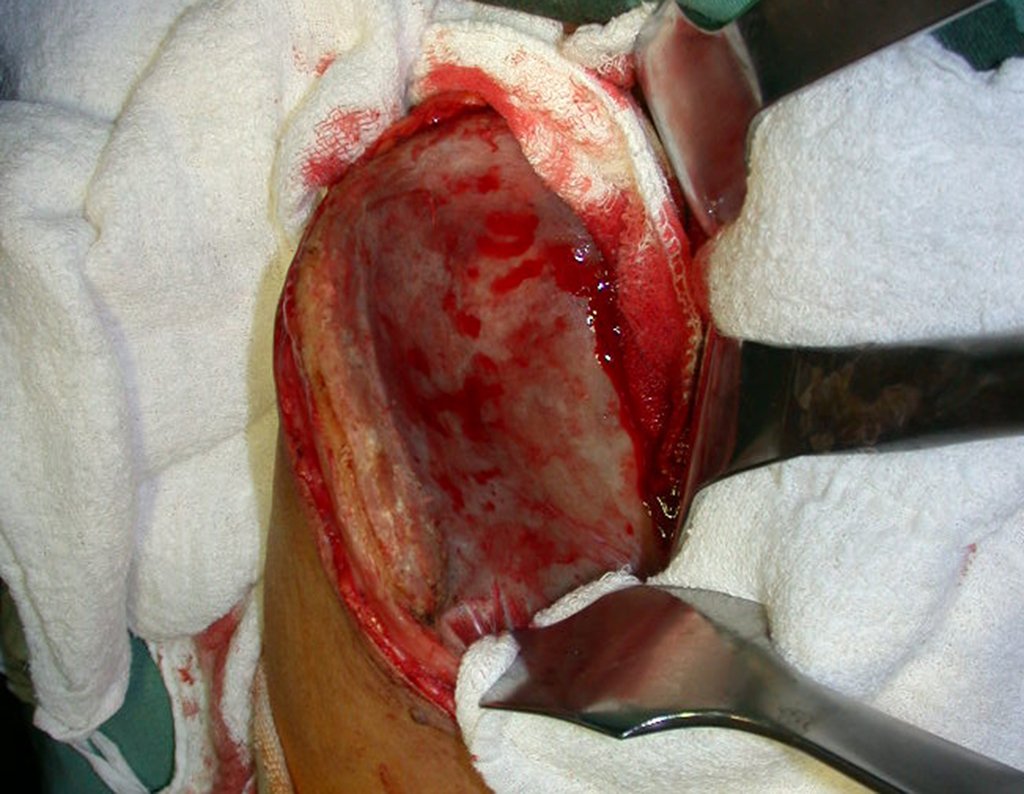
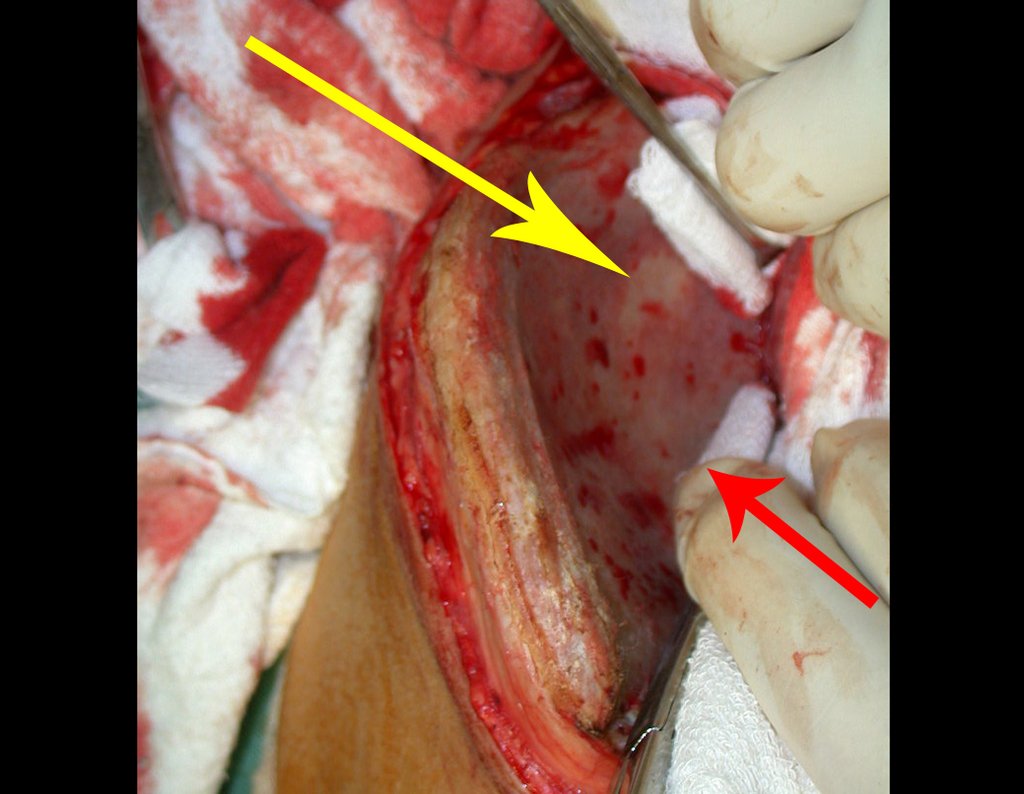
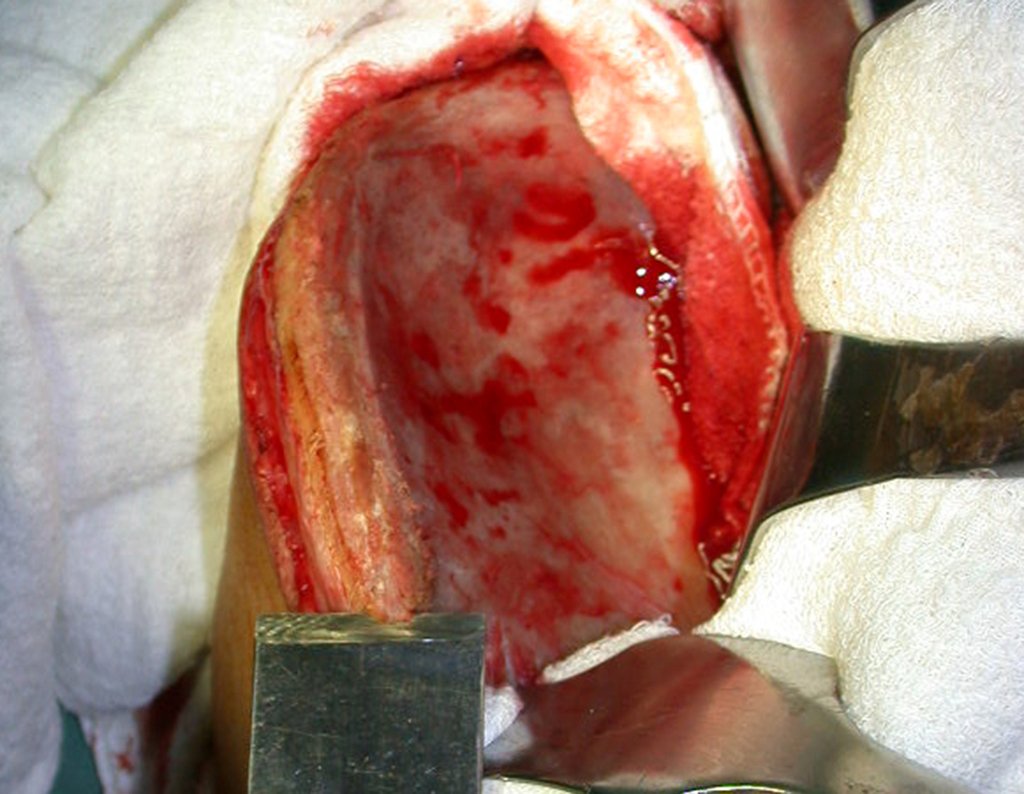
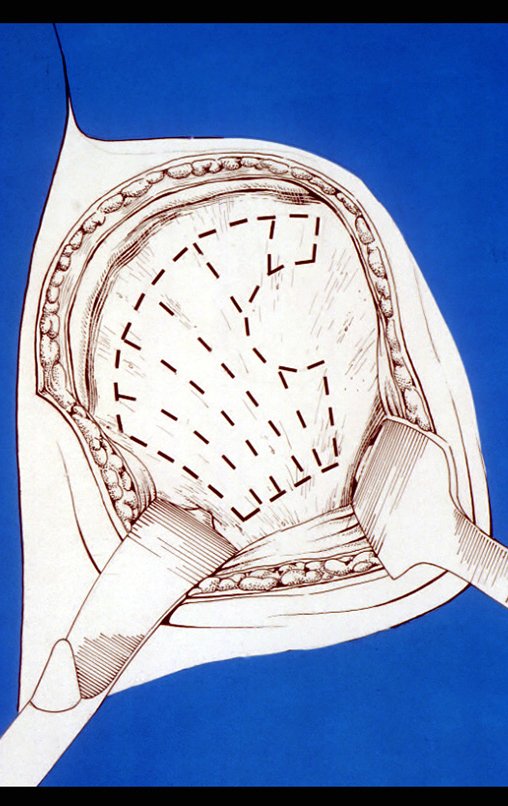
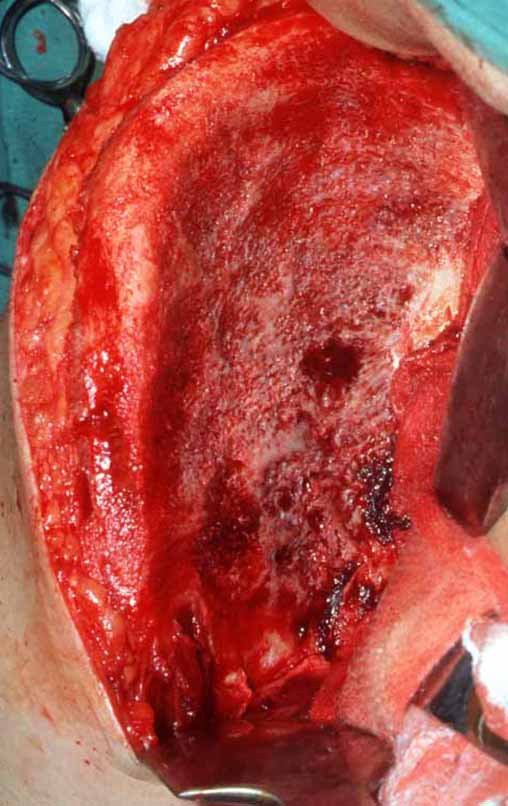
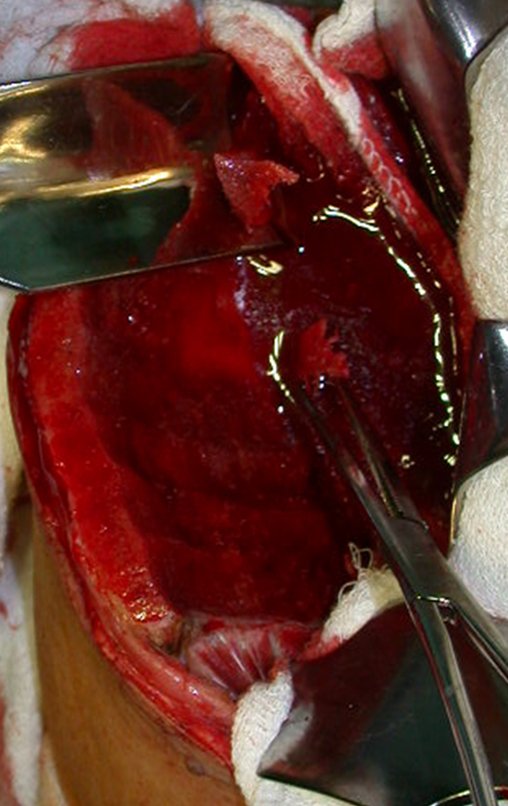
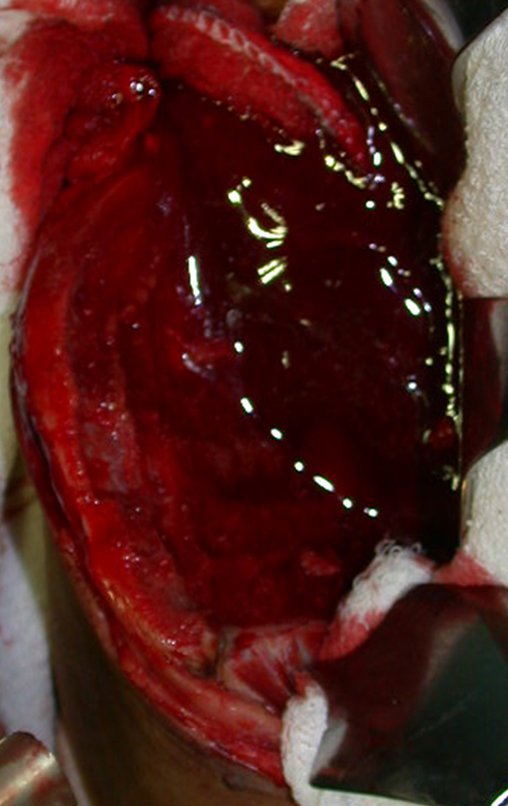
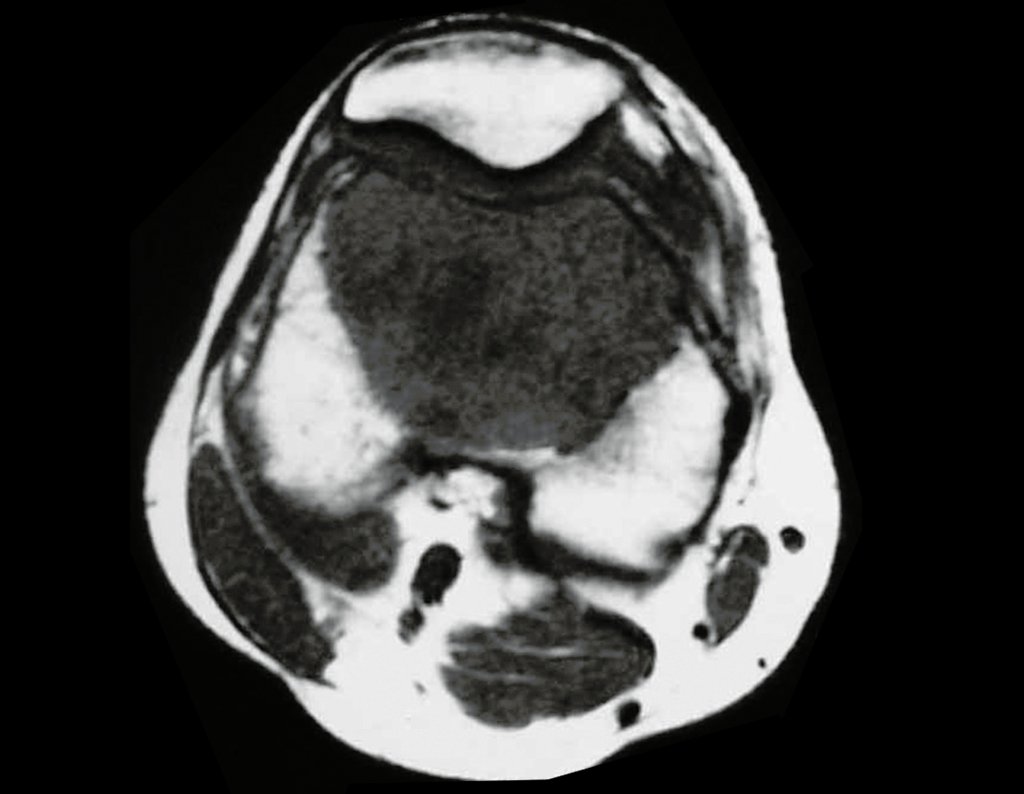
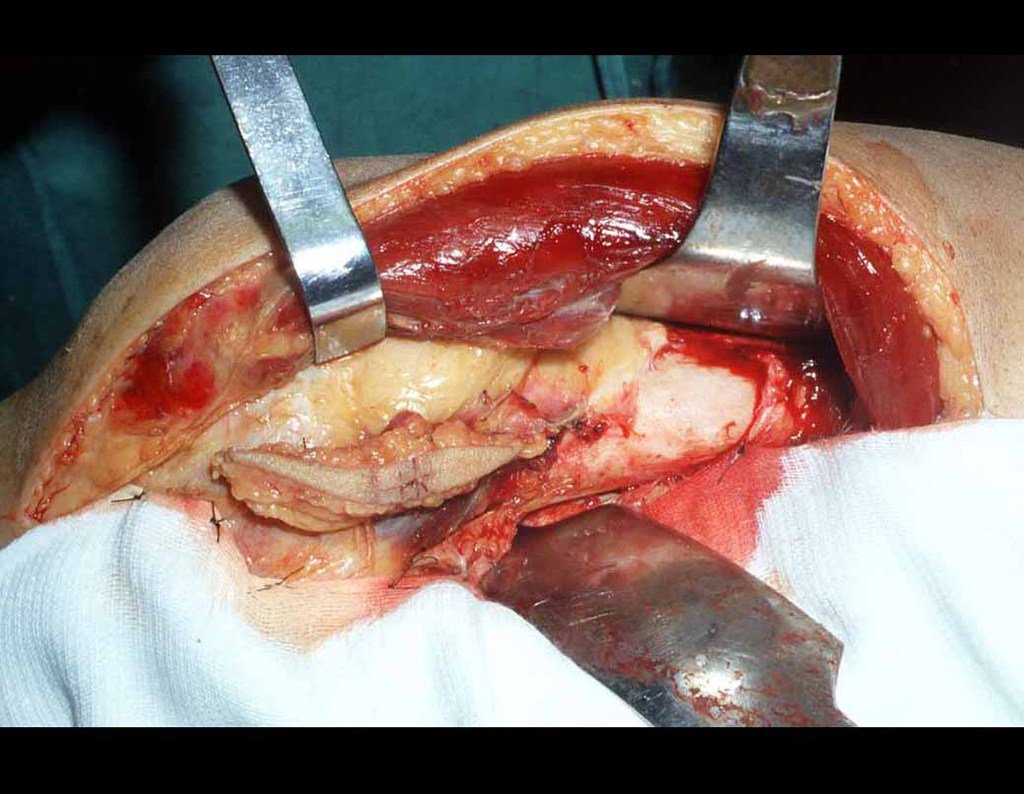
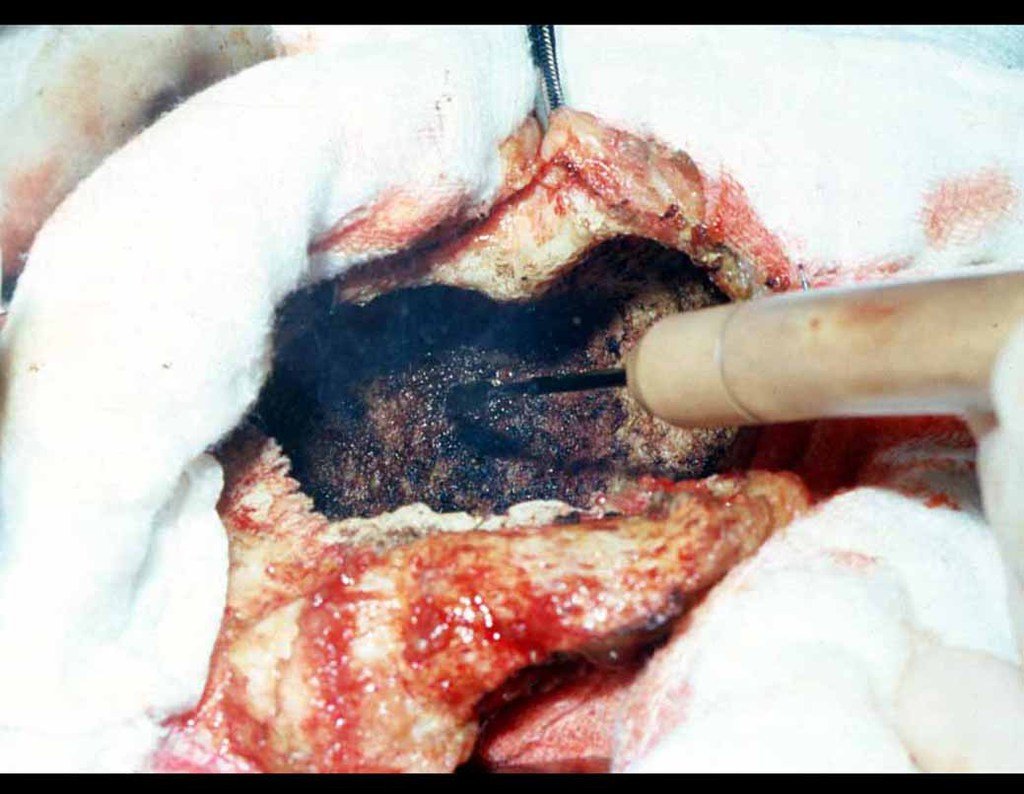
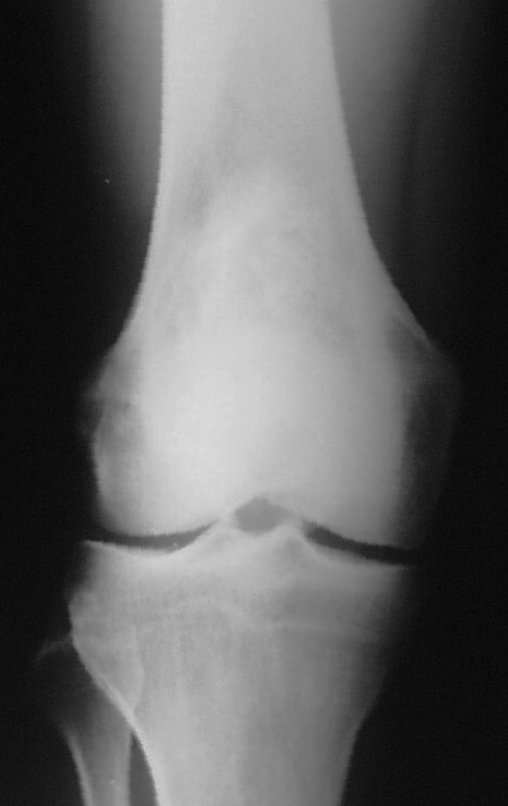
Cisto Ganglionar Intra Neural – Ganglion
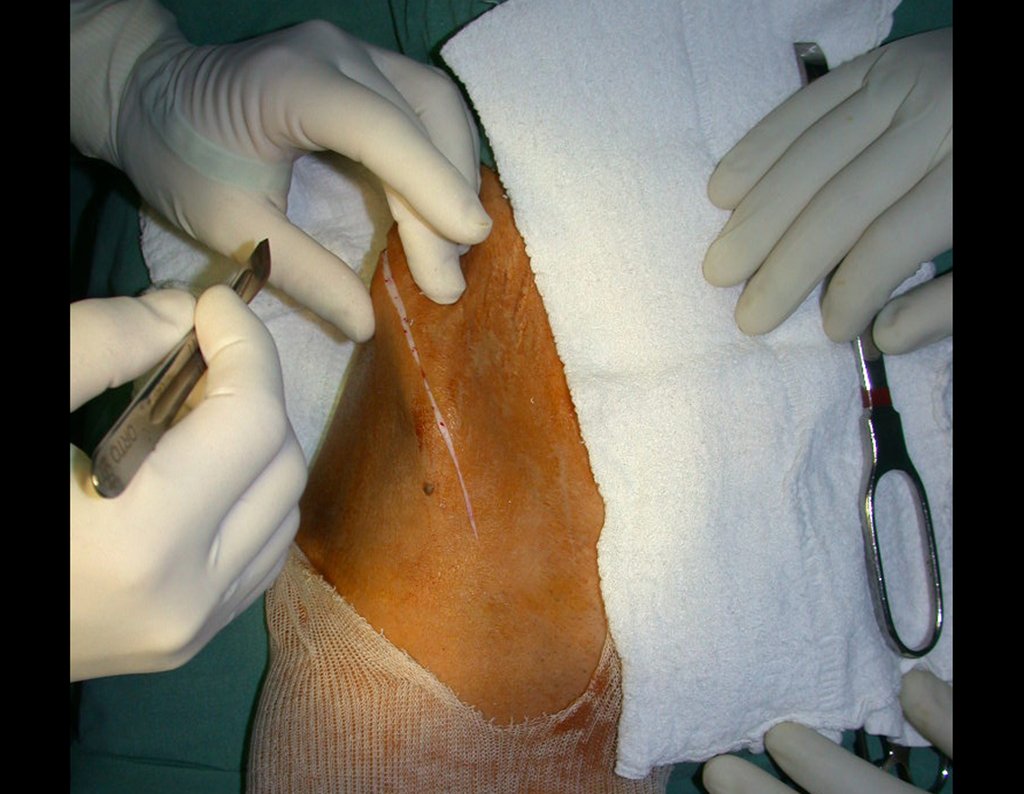
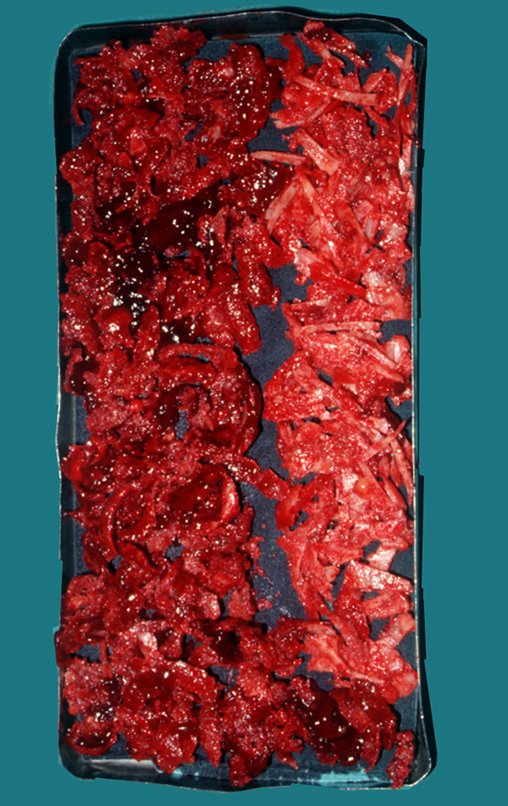
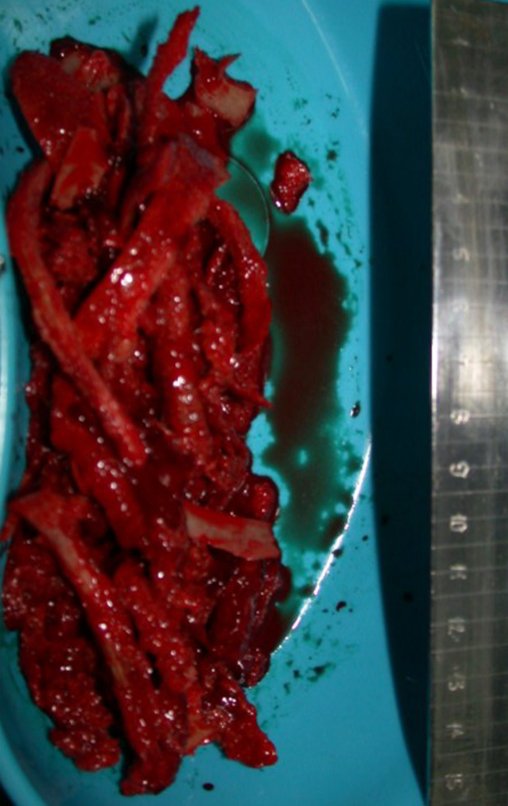
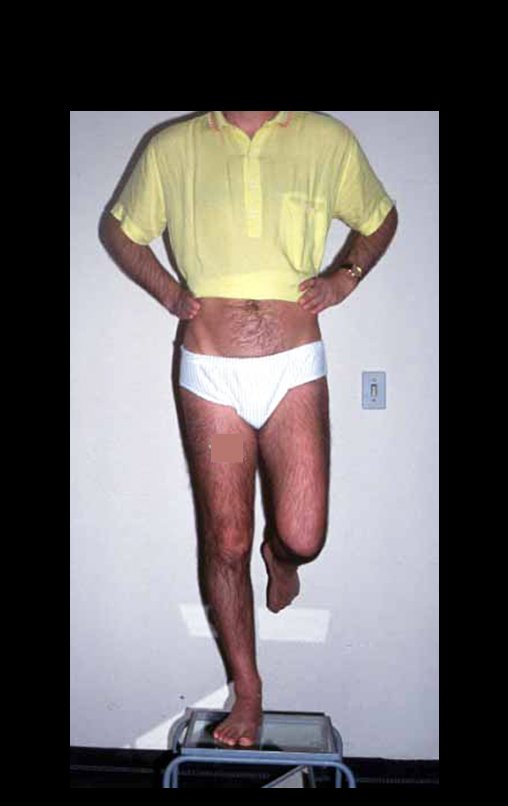
O cisto ganglionar intra neural é uma lesão rara, caracterizada pela sua presença dentro de um nervo periférico. Trata-se de uma formação benigna que contém um líquido gelatinoso similar ao encontrado nos cistos ganglionares comuns, os quais geralmente ocorrem perto de articulações ou tendões.
A localização intra neural, no entanto, diferencia esse cisto por causar sintomas específicos relacionados à compressão do nervo afetado, ocasionando sintomas de neuropraxia, que podem evoluir para paralisia motora. Por isso, deve ser tratado assim que diagnosticado, evitando-se a consequente degeneração gordurosa da musculatura envolvida, o que inviabilizaria a recuperação funcional.
A patogênese dos cistos intra neurais tem duas teorias: uma que sugere a formação cística isolada dentro do nervo devido a um processo degenerativo, enquanto a outra sugere que os cistos se originam de uma articulação vizinha, estendendo-se das articulações ao longo da adventícia de um ramo articular, assim como fazem ao longo do perineuro dentro dos feixes neuro vasculares, dada a forte associação de cistos intra neurais com articulações próximas.
Uma teoria unificada, baseada no nervo fibular, que é o mais comumente afetado, sugere que cistos para-articulares surgem de articulações com pressão intra-articular elevada. Essa pressão faria com que o material cístico se estendesse por rupturas ou regiões enfraquecidas da cápsula articular, seguindo caminhos de menor resistência, resultando em cistos tanto extra neurais quanto intra neurais. Essa teoria também foi estendida para explicar cistos em outros nervos, como o tibial, ulnar, mediano e supra escapular, em diversas articulações.
Os cistos podem se propagar por várias rotas, incluindo artérias, veias e nervos, levando a diferentes combinações de cistos. A presença simultânea de cistos intra neurais em nervos distintos, como o fibular e o tibial, associados a cistos vasculares e intramusculares no mesmo local, sugere uma relação causal comum, reforçando a ideia de um mecanismo compartilhado na formação desses cistos.
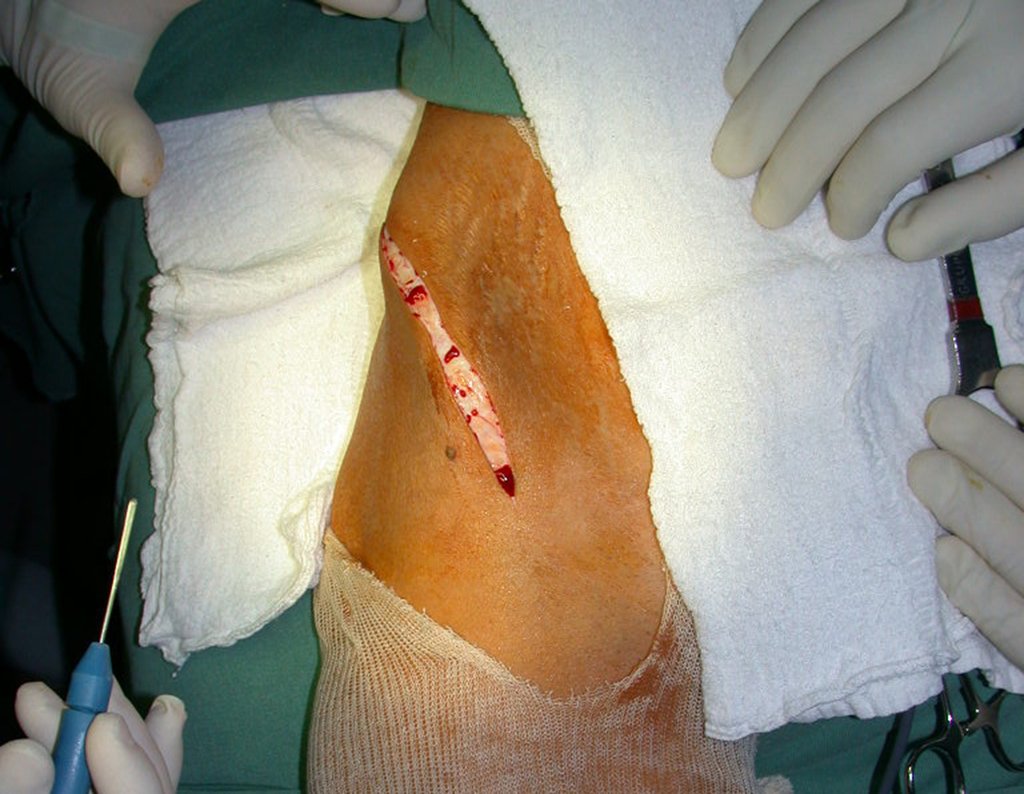
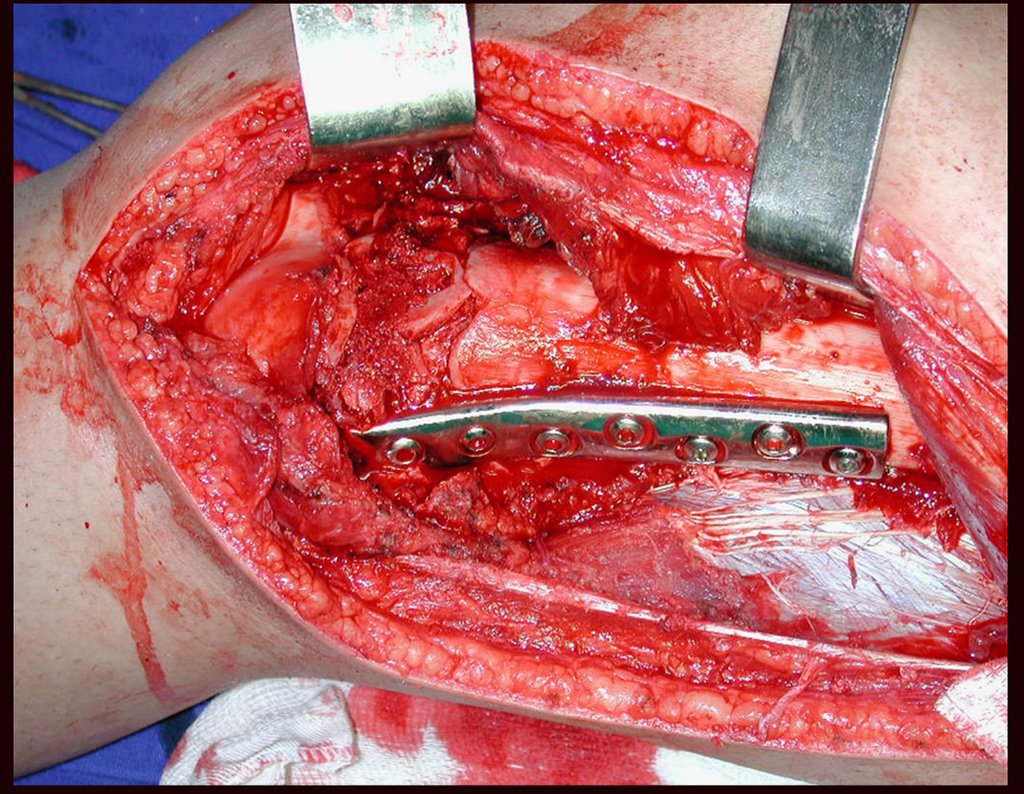
O tratamento cirúrgico, executado com a descompressão articular e a neurolise, deve ser o mais precoce possível. Estes cistos ganglionares intra neurais podem causar uma variedade de sintomas, dependendo do nervo envolvido e da extensão da compressão. Os sintomas comuns incluem dor, fraqueza muscular, dormência e parestesias (sensações anormais, como formigamento). Esses sintomas podem ser progressivos, à medida que o cisto aumenta de tamanho, exercendo maior pressão sobre as fibras nervosas.
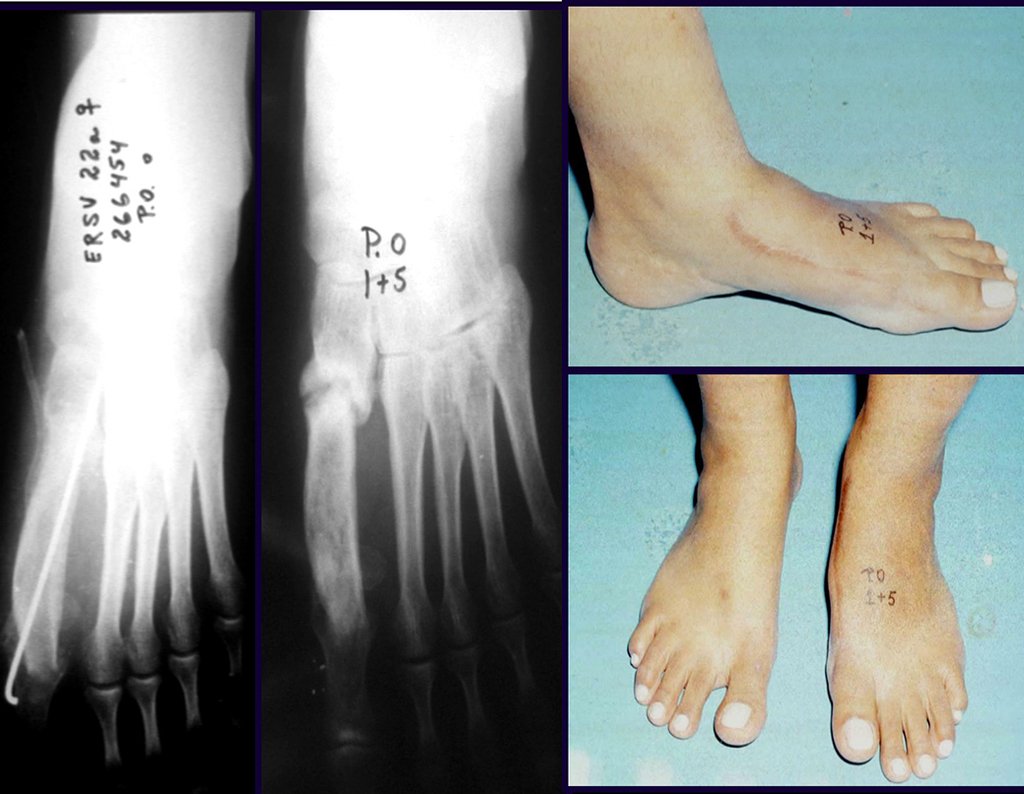
O diagnóstico de um cisto ganglionar intra neural geralmente envolve a realização de exames de imagem, sendo a ressonância magnética (RM) o melhor método para o diagnóstico. Esses exames permitem a visualização do cisto e ajudam a determinar sua localização, tamanho e eventual compressão articular existente. A ressonância magnética pode ser complementada pela tomografia neste estudo articular, que, associada à RM, torna-se mais eficaz para avaliar a relação do cisto com as estruturas nervosas e osteoarticulares adjacentes.
O tratamento de cistos ganglionares intra neurais pode variar dependendo da gravidade dos sintomas e do impacto na função nervosa. A aspiração com agulha guiada por ultrassonografia pode ser realizada para drenar o conteúdo do cisto. No entanto, há o risco de recorrência, pois a aspiração não remove a parede do cisto e não trata a compressão articular, quando existente.
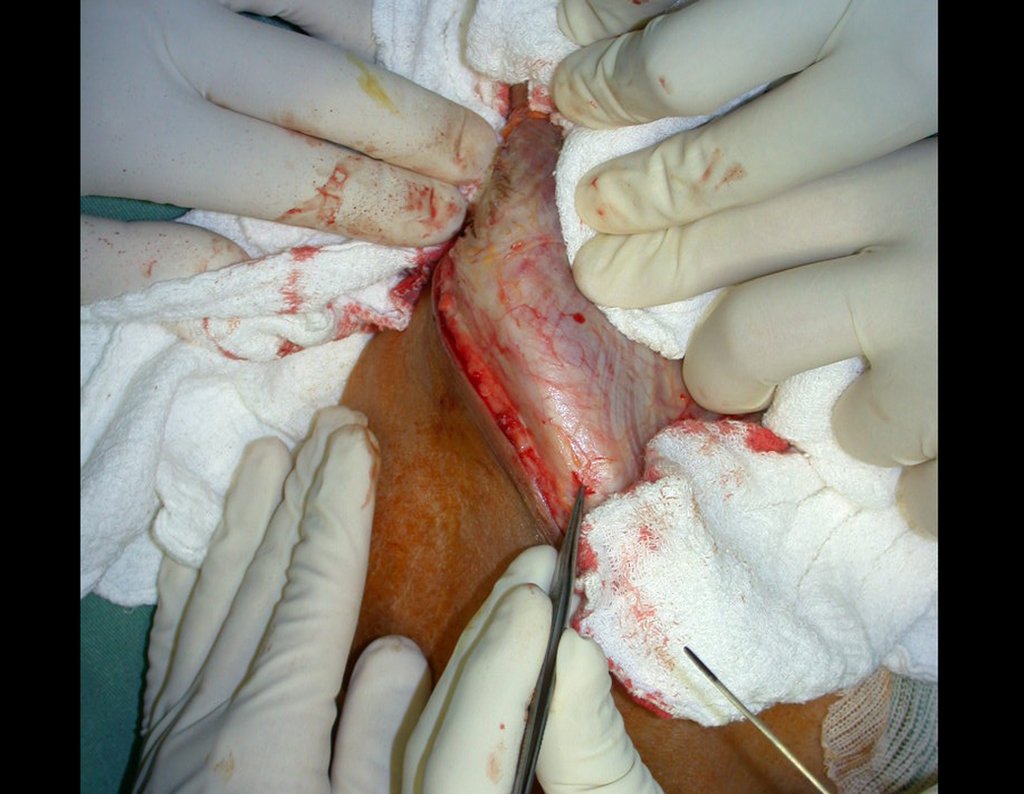
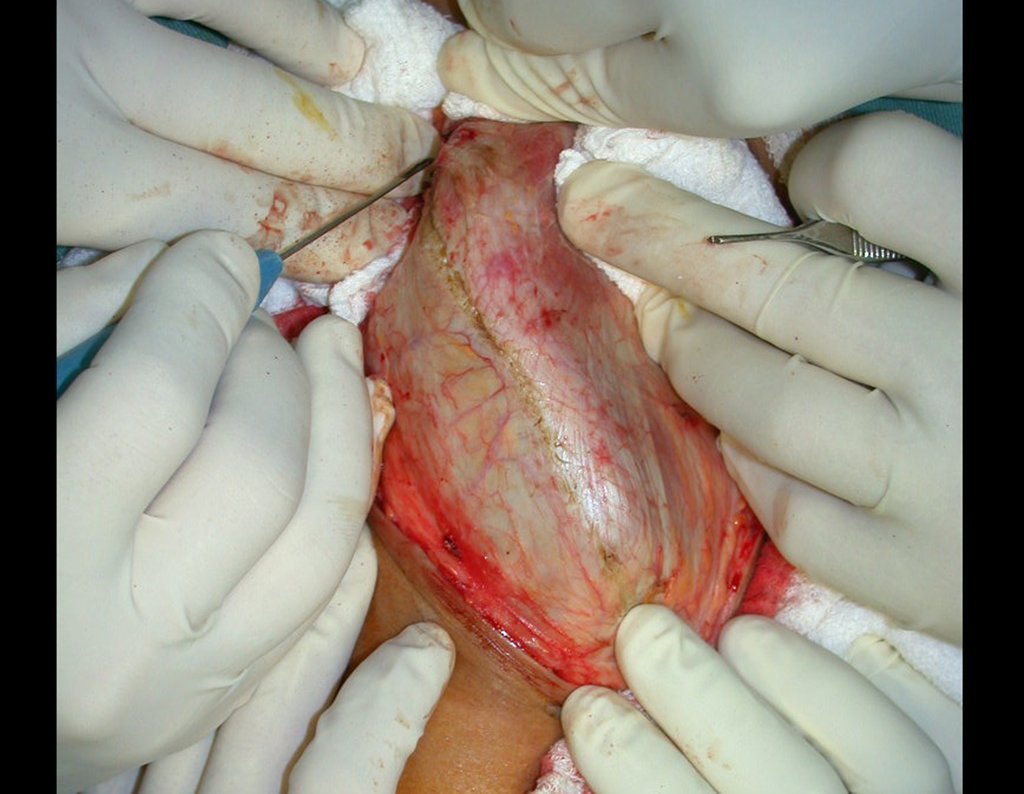
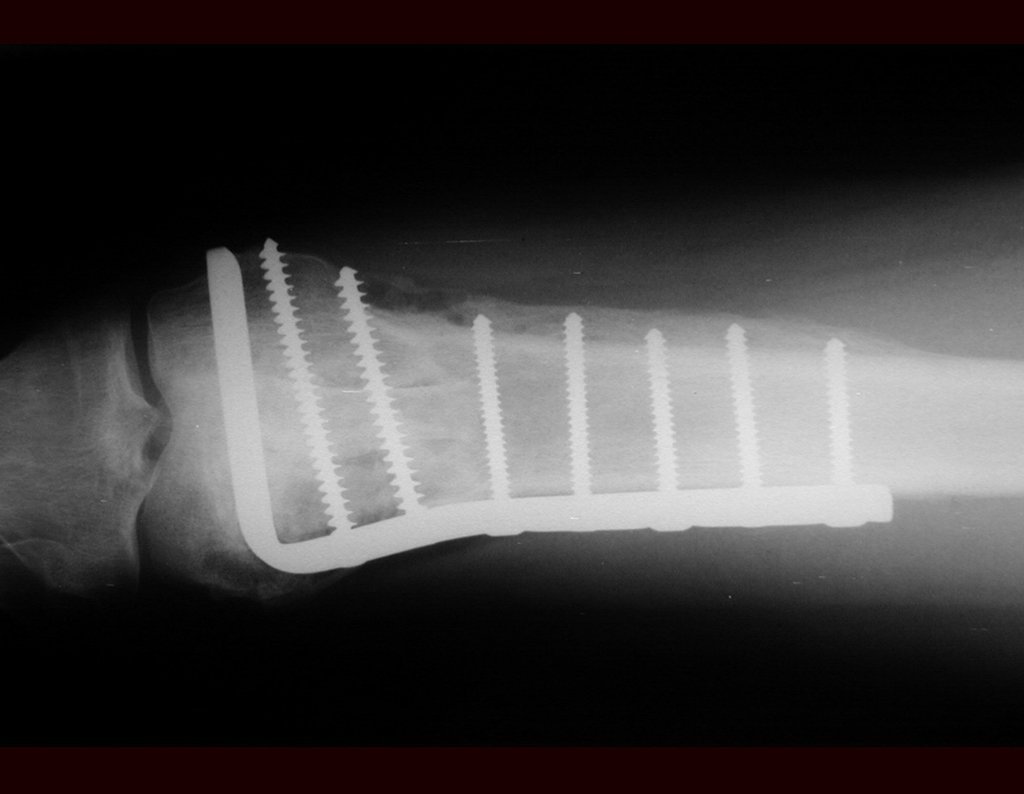
Em casos de sintomas graves ou progressivos, a remoção cirúrgica do cisto pode ser necessária. A cirurgia visa remover o cisto completamente, incluindo sua parede, para minimizar o risco de recorrência, além de realizar a descompressão articular. O procedimento cirúrgico deve ser cuidadoso, visando preservar a integridade do nervo afetado.
O prognóstico para pacientes com cisto ganglionar intra neural é geralmente bom, especialmente quando o diagnóstico é precoce e o cisto é tratado adequadamente. A remoção cirúrgica completa tende a oferecer os melhores resultados, com alívio significativo dos sintomas e baixo risco de recorrência. No entanto, a recuperação pode depender da extensão da lesão nervosa pré-existente e da eficácia da intervenção cirúrgica.
Em resumo, o cisto ganglionar intra neural é uma condição rara que pode causar sintomas neurológicos significativos devido à compressão nervosa. O diagnóstico precoce e o tratamento adequado são essenciais para prevenir danos nervosos permanentes e proporcionar alívio sintomático aos pacientes afetados.
Confira abaixo o vídeo da Aula.

Giroplastia de Van Nes & Transplante Autólogo de Cartilagem de Crescimento
Albert G. Van Nes, cirurgião holandês, descreveu sua técnica cirúrgica chamada “giroplastia de Van Nes” ou “rotação de Van Nes”, em 1950.
Esta técnica consiste em uma ressecção intercalar e a rotação de 180 graus do membro inferior, de modo que o tornozelo passa a funcionar como uma nova articulação do joelho. A técnica de Van Nes foi inicialmente desenvolvida para tratar casos de sarcoma de Ewing e osteossarcoma, especialmente em crianças, permitindo uma alternativa à amputação total do membro.
A ideia era criar um “joelho biológico” utilizando o próprio tornozelo do paciente, uma vez que as tecnologias protéticas da época não eram avançadas ou acessíveis. A giroplastia de Van Nes permite que o paciente utilize órtese de forma mais eficiente, mantendo uma funcionalidade mais natural e uma melhor qualidade de vida em comparação com a amputação tradicional
Nesta aula, vamos discutir o tratamento dos sarcomas ósseos que afetam as crianças em crescimento, apresentando a técnica de Van Nes e o auto transplante de cartilagem de crescimento.
Na década de 1980, a literatura indicava a amputação dos membros acometidos por sarcomas ósseos em crianças menores de 10 anos de idade. Isso se devia tanto aos recursos cirúrgicos da época quanto aos altos índices de maus resultados com a cirurgia conservadora, em virtude da acentuada discrepância dos membros que ocorreria com o crescimento. Outros dogmas também estabeleciam a ablação nos casos de envolvimento vascular.
Ainda no Congresso Brasileiro de Ortopedia de 1988, realizado em Brasília, esse conceito era consenso. Entretanto, já contestávamos essa premissa, afirmando que o comprometimento vascular poderia ser contornado com a realização de enxertos vasculares, apresentando casos que tratamos com ressecção oncológica e reconstrução com anastomose vascular, como este caso de osteossarcoma envolvendo a artéria e a veia poplítea, que foi ressecado em bloco e reconstruído com enxerto vascular e endoprótese.
Naquela época, a cirurgia ablativa era indicada para lesões tumorais que envolviam o feixe vascular, para aquelas que apresentavam comprometimento dos tecidos moles, para tumores com mais de 12 cm ou com fratura, e também para lesões neoplásicas em crianças menores de 10 anos. Para esses casos, a amputação era uma das alternativas.
Entretanto, em 1992, conhecemos o Professor Capanna no congresso da SBOT, em São Paulo, que nos apresentou a técnica de Van Nes, indicada para esses casos. Essa giroplastia consiste em uma ressecção intercalar, criando uma deformidade de difícil aceitação em nosso meio latino, requerendo consentimento por parte do paciente e familiares, além de apresentar dificuldades na confecção da órtese para o paciente.
Optamos pela giroplastia de Van Nes em dois casos, visto que essa técnica não impediria uma futura conversão para amputação, caso não houvesse sucesso.
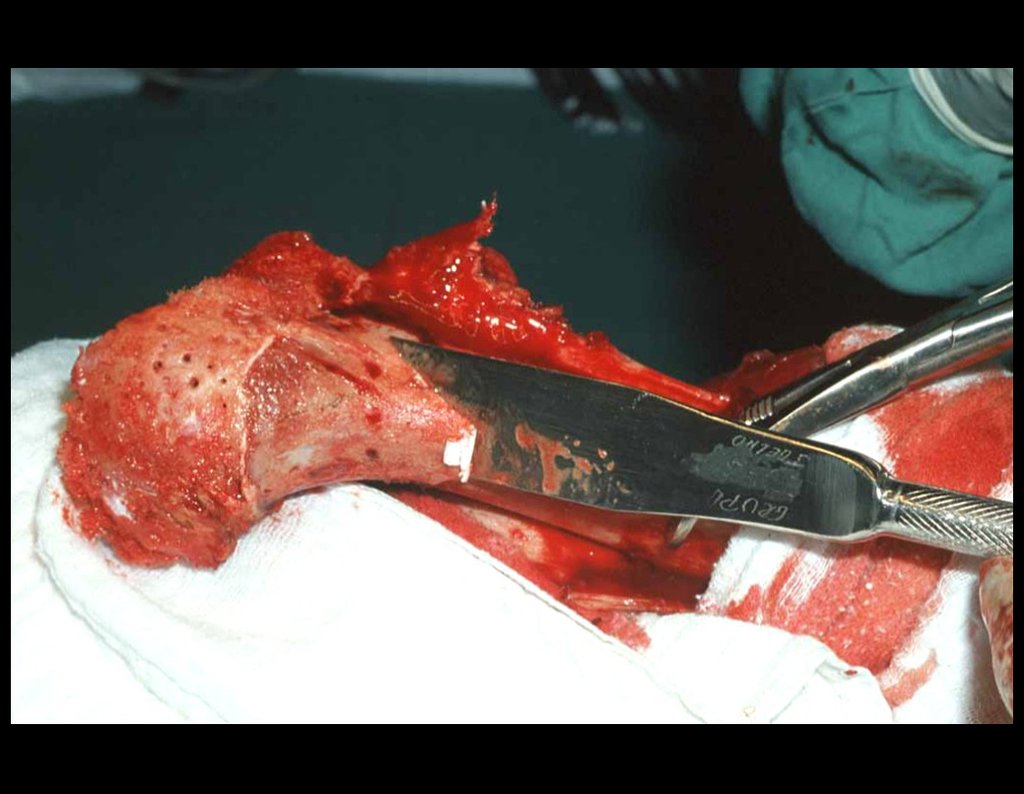
No primeiro caso, tratava-se de um osteossarcoma no terço distal da coxa direita, comprometendo o fêmur, os músculos e o feixe vascular da região. A indicação da giroplastia foi executada, realizando-se uma ressecção oncológica intercalar, ao invés de uma amputação total ao nível do terço proximal do fêmur. Optamos por realizar a Giroplastia de Van Nes, que consiste em uma ressecção intercalar dos dois terços distais da coxa e do segmento proximal da perna, com preservação do feixe vascular (artéria e veia) e do nervo ciático. Trata-se de uma ressecção em bloco, incluindo pele, músculos, ossos e tecido subcutâneo da região, com margem oncológica, preservando a irrigação e inervação da extremidade remanescente.
Na Giroplastia de Van Nes, executamos uma rotação de 180° da extremidade inferior do membro operado e calculamos a extensão necessária do segmento da perna operada, de modo que, ao final da maturidade esquelética do paciente, o nível final da articulação do joelho sadio esteja equiparado ao do tornozelo contralateral. Dessa forma, o nível da articulação do joelho sadio ficará simétrico ao do tornozelo do lado operado, que funcionará como uma neo-articulação, proporcionando simetria ao paciente na posição sentado.
A placa de crescimento da tíbia esquerda, que é o lado sadio, tem um potencial de crescimento maior do que a placa distal da tíbia direita, que é a do lado operado. Esse maior potencial de crescimento, somado ao maior tamanho deixado, permitirá alcançar simetria ao final da puberdade. Tivemos dificuldade em confeccionar essa órtese sob medida, mas ela apresentou um bom resultado funcional, com apoio terminal no pé e propriocepção. Entretanto, a aceitação por parte dos familiares foi bastante problemática.
Ainda em 1997, a literatura mundial indicava a amputação como tratamento para tumores do membro inferior em crianças menores de 10 anos de idade, devido à futura discrepância do membro inferior. Chamamos a atenção para o fato de que a placa de crescimento da fíbula fica ao nível da articulação do tornozelo, enquanto a placa de crescimento da tíbia se encontra em um nível superior. Planejamos, assim, uma transferência da fíbula distal para a tíbia após a ressecção do tumor. Vale destacar que a artéria nutrícia da fíbula e sua placa de crescimento entram no terço proximal da fíbula. Portanto, nossa osteotomia fibular deve ser realizada acima dessa entrada. Precisamos também realizar uma janela lateral para o encavilhamento proximal, seguida da criação de uma cavidade no tálus para receber a epífise fibular com sua placa de crescimento.
Vamos realizar uma artrodese entre o tálus e a tíbia remanescente, utilizando a epífise fibular com sua cartilagem epifisária já removida, transladando-a pela membrana interóssea. Dessa forma, executaremos uma transferência da cartilagem de crescimento da fíbula para a tíbia, realizando um autotransplante da placa de crescimento através da membrana interóssea.
Para finalizar a artrodese, fazemos uma cavidade oval no tálus para adaptar a epífise fibular, completando assim a artrodese com a integração da epífise fibular. Finalizamos esta reconstrução fixando com um pino de Steinmann pelo calcâneo. Acomodamos o membro operado na órtese modelada para esta paciente, obtendo uma transferência da placa de crescimento da fíbula para a tíbia, finalizando assim o procedimento.
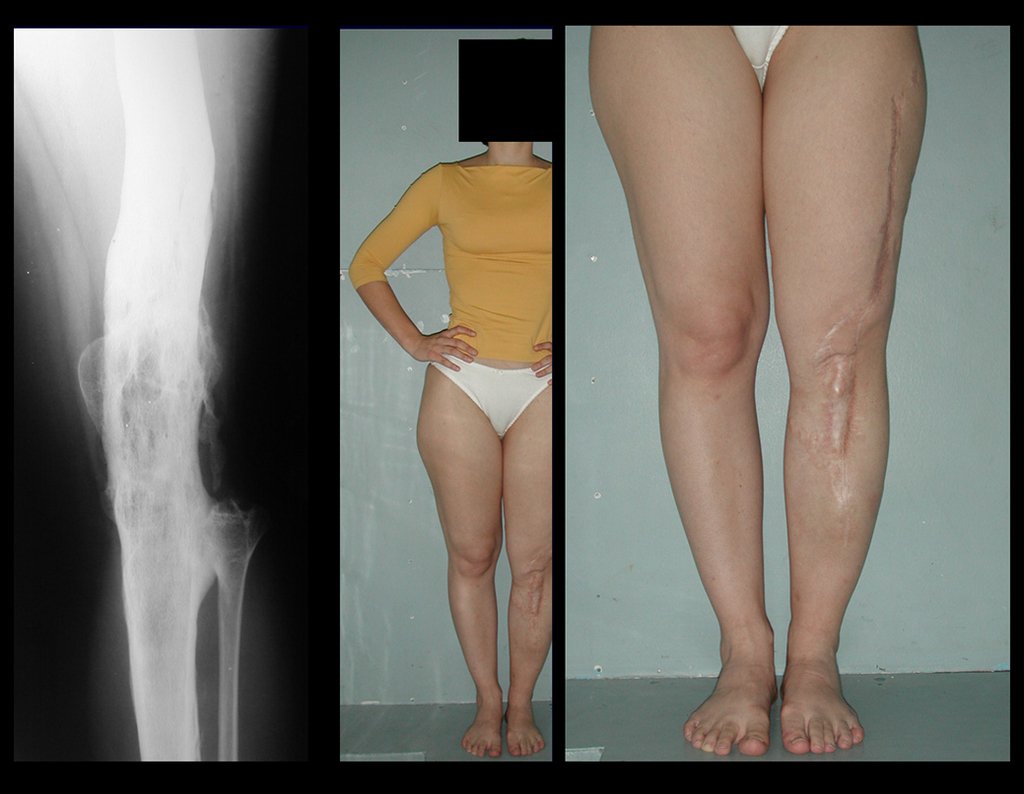
No primeiro caso, com cinco meses, pudemos observar a neoformação óssea e a transferência da placa fibular para a tíbia. No mapeamento, constatamos que este segmento estava vascularizado, confirmando o sucesso deste autotransplante. Com um ano e cinco meses, pudemos observar a boa integração óssea e o espessamento da nova tíbia com a placa fibular transladada e viável. Após dois anos, a paciente apresentava bom apoio e função, tanto em flexão dos joelhos quanto em carga monopodal.
No segundo caso de autotransplante de cartilagem ao nível do tornozelo, observamos uma lesão de rarefação óssea na metáfise distal da tíbia, com limites imprecisos que ultrapassavam as corticais, lateral, anterior e posterior. A cintilografia apresentava aumento de captação no tornozelo, evidenciado no PET-CT. Nos cortes de ressonância magnética axial e sagital T2 com supressão de gordura, observamos um tumor extra cortical de grande volume, com alto sinal. Confeccionamos um molde gessado inguino-podálico para servir de base para a órtese que foi confeccionada sob medida. A radiografia final confirmou o posicionamento do fio de Kirchner, estabilizando a reconstrução.
Agradeço aos ensinamentos recebidos do Prof. Rodolfo Capanna, desde 1992, e à contínua troca de conhecimentos com o Prof. Eduardo José Ortiz Cruz, de Madri, Espanha.
Realizamos esta técnica de autotransplante em outras crianças, em diferentes ossos, como úmero e tíbia, que publicamos na revista SpringerPlus.
Link: https://springerplus.springeropen.com/articles/10.1186/s40064-016-2042-7
Concluímos, com nossa experiência que “o transplante autólogo de cartilagem de crescimento é uma boa alternativa para as reconstruções biológicas em crianças.”
Confira abaixo o vídeo da Aula.
Confira abaixo o vídeo da cirurgia.
Artrodese do Joelho com Solução Protética ou Biológica
Em alguns casos de tumores ósseos e de traumas graves, as falências de próteses ou osteossíntese podem representar um desafio significativo. É nesse cenário que a artrodese do joelho emerge como uma alternativa viável. Esta técnica pode ser realizada de diversas maneiras, sendo uma delas com uma prótese do tipo diafisária ou através de uma solução biológica empregando-se enxerto autólogo e osteossíntese.
Por exemplo, quando nos deparamos com a falência de uma prótese primária infectada ou em situações de tumores ósseos agressivos ou traumas, a artrodese pode se tornar uma alternativa à amputação.
Consideremos este caso de condrossarcoma recidivado, após duas tentativas cirúrgicas, sem sucesso, em que a necessidade de uma ressecção ampla se faz presente, e a reconstrução com uma artrodese, pode ser a única alternativa para evitarmos a amputação. Nesses casos, a artrodese empregando uma prótese diafisária pode oferecer a chance de preservação deste membro.
O sucesso exige uma ressecção cuidadosa, com a remoção dos tecidos comprometidos, preservando os vasos poplíteos e nervos da região. Em seguida, é realizada a reconstrução com uma prótese modular do tipo diafisária, neste caso foi especialmente moldada, com a confecção de um segmento de polietileno, visando dar um formato mais estético para a região do “neo joelho”, minimizando o defeito deixado pela extensa ressecção do segmento afetado pelo tumor e atendendo ao objetivo de garantir uma ressecção ampla, com margens oncológicas seguras.
Neste outro exemplo de um tumor de células gigantes, que destruiu todo o planalto tibial e o 1/3 proximal da tíbia, a abordagem pode ser biológica. Nesse paciente, aproveitamos o osso autólogo do próprio local, no caso dos côndilos femorais, para preencher a falha óssea deixada pela ressecção da neoplasia.
É importante ressaltar que a técnica exige precisão e cuidado, tanto na ressecção quanto na reconstrução. A placa utilizada na fixação deve ser posicionada de forma a garantir um alinhamento adequado e evitar rotações indesejadas. A integração da artrodese com o enxerto autólogo biológico é fundamental para o sucesso do procedimento.
Em casos de traumatismos graves, com grande destruição óssea devido a traumas de alta energia, a artrodese pode ser a única opção viável para restaurar a estabilidade do membro e evitar a amputação. Esses casos, que estamos mostrando, foram apresentados no Congresso Internacional de Trauma no Joelho, em Ribeirão Preto – SP, mostrando a nossa experiência com estas duas técnicas de artrodese, empregando próteses diafisária ou osteossíntese com reconstrução biológica. Para mais informações sobre essas técnicas e apreciação de outros casos clínicos semelhantes, visite o site www.oncocirurgia.com.br,
Através do compartilhamento de conhecimento e experiências, poderemos avançar no desenvolvimento para o tratamento de condições ortopédicas complexas.

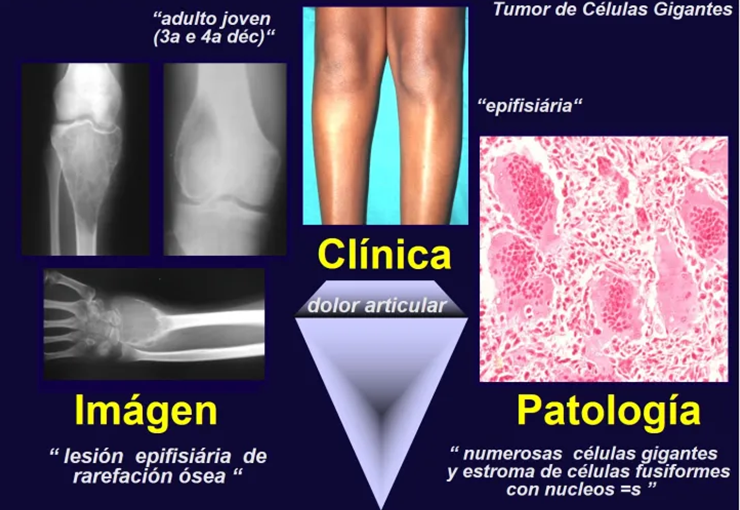
Tumor de Células Gigantes
‘Tumor de Células Gigantes.
O Tumor giganto-celular é neoplasia de natureza mesenquimal, caracterizada por proliferação de células gigantes multinucleadas – gigantócitos – que se assemelham aos osteoclastos, em meio a estroma de células mononucleadas.
Devido a esse aspecto histológico presente em diversos outros processos, o tumor giganto-celular poderia confundir-se necessitando muitas vezes da análise do aspecto clínico e radiográfico, para a confirmação do seu diagnóstico.
O tumor giganto-celular é também conhecido pela sigla TGC, pelos nomes de tumor de células gigantes e osteoclastoma.
A manifestação principal é a dor local intermitente, acompanhada ou não de aumento de volume da região afetada e limitação dos movimentos da articulação vizinha. O tempo de história, em média de 6 a 12 meses, é variável de caso a caso e depende do osso afetado.
Alguns doentes procuram tratamento em virtude da dor, outros pela percepção do tumor ou por fratura patológica. Não é rara a referência a trauma mais ou menos intenso como início da história clínica.
Como na maioria das vezes o tumor é epifisário, é freqüente o comprometimento clínico da articulação vizinha, com progressiva impotência funcional.
Pode ocorrer derrame articular e quadro clínico simulando processos meniscais ou de artrite.
Nos tumores localizados na coluna vertebral e no sacro além da dor e aumento de volume pode ocorrer manifestações neurológicas. O volume às vezes é enorme predominando sobre os demais sintomas.
O tumor giganto-celular em geral acomete um só osso. Quando há lesões em vários ossos deve-se verificar a possibilidade de tratar-se de “tumor marrom do hiperparatireoidismo”, cujas lesões apresentam aspectos radiográficos semelhantes, mas são múltiplas e o paciente apresenta alteração do cálcio e fósforo.
O TGC é classicamente conhecido como tumor da epífise de ossos longos, mais freqüentes na região do joelho, isto é, na epífise distal do fêmur e proximal da tíbia e, em seguida por ordem de freqüência, na região proximal do úmero e distal do rádio. No esqueleto axial é raro e quando ocorre tem predominância no sacro.
Ocorre na terceira e quarta década, comprometendo igualmente ambos os sexos.
Radiograficamente é descrito como lesão epifisária caracterizada por rarefação óssea, de início excêntrica, inicialmente respeitando os limites da cortical. Com a evolução, pode ocorrer ruptura da cortical e comprometimento articular (fig. 27).
Histologicamente as células gigantes e o estroma são os elementos mais importantes deste tumor. Caracteriza-se por apresentar numerosas células gigantes que se assemelham-se aos osteoclastos em meio a estroma de células fusiformes.
Os principais diagnósticos diferenciais clínico, radiográfico e anatomopatológico são com cisto ósseo aneurismático, osteossarcoma teleangectásico e condroblastoma.
O tratamento do tumor de células gigantes atualmente está bem estabelecido. Deve-se optar, sempre que possível, pela ressecção segmentar da lesão, com margem de segurança oncológica tanto óssea como nas partes moles. Desta forma o cirurgião propiciará a maior oportunidade de cura, sem riscos de recorrência.
Entretanto, em regiões em que a ressecção segmentar não é factível, coluna cervical por exemplo, deve-se realizar a curetagem endocavitária mais criteriosa possível e complementar com terapia adjuvante tais como o laser CO2, o fenol diluído em álcool à 4 %, o nitrogênio líquido e a eletrotermia. O metilmetacrilato tem baixo efeito adjuvante e, quando empregado para preenchimento da cavidade, deve ser precedido por uma das terapias mencionadas.
No passado, a curetagem apresentava altos índices de recidiva em virtude de não se fazer aberturas amplas para uma limpeza eficaz e pelo não uso de adjuvantes locais. Hoje, quando se indica a curetagem endocavitária, preconiza-se a execução de grande janela óssea para permitir ao cirurgião ampla visão da cavidade. Realizamos ainda uma complementação desta curetagem com o emprego do bisturi elétrico (eletrotermia).
Esta técnica da eletrotermia é bastante eficaz pois com a ponta curvada do bisturi conseguimos atingir áreas de acesso mais difícil . Este bisturi, além da cauterização, realiza também uma complementação da curetagem, à medida que aquelas células tumorais, remanescentes nas pequenas “cáries” da parede óssea, são destruídas e vão desprendendo-se, permitindo sua mais fácil remoção.
Complementamos nossa curetagem, após o emprego da eletrotermia, com a fresagem da cavidade. Utilizamos para isto o lentodril, com fresa odontológica esférica.
Na região do joelho (extremidade distal do fêmur e proximal da tíbia), local de maior incidência do TGC, indicamos freqüentemente a curetagem endocavitária, seguida da eletrotermia e fresagem com lentodril. Isto porque a ressecção segmentar desta região implicaria em artrodese ou substituição por Endopróteses ou enxertos homólogos. A artrodese da articulação do joelho é a que ocasiona maior limitação para o paciente e deve ser evitada. As substituições em pacientes jovens podem traduzir-se em problemas num futuro próximo, e sua indicação deve ser criteriosa.
Desta forma, indicamos primeiramente a terapêutica mais conservadora: – curetagem seguida de adjuvância para está região, exceto em casos avançados, já com destruição importante da estrutura óssea, em que tanto a função quanto o controle local da doença venham a ser comprometidos.
Resta ainda um breve comentário quanto ao preenchimento da cavidade tratada. Este pode ser feito com enxerto ósseo autólogo, heterólogo ou com metilmetacrilato, cada um deles com suas vantagem e desvantagens.
O metilmetacrilato permite visualizar eventuais recidivas com facilidade, é de fácil emprego e permite carga mais precocemente, entretanto não é solução biológica e podem ocorrer fraturas na região.
O enxerto ósseo é solução biológica e definitiva, entretanto dificulta a visualização de possível recidiva precoce, que pode confundir-se com reabsorção/integração do enxerto e ainda requer seis meses em média para carga total. O enxerto homólogo tem maior período de integração, nem sempre é disponível mas por outro lado encurta o tempo cirúrgico. O enxerto autólogo tem a vantagem da biocompatibilidade e da integração mais rápida porém prolonga o tempo cirúrgico.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
Para melhor compreensão, sugerimos que leia primeiramente os capítulos:
https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/
Considerações sobre Biópsia
1. Somente após a avaliação clínica, com a realização da anamnese e exame clínico cuidadosos, que nos permitirão levantar as hipóteses de diagnósticos, é que deveremos solicitar os exames complementares.
Com a análise dos exames complementares deveremos verificar:
A- Se nossas hipóteses são compatíveis com os exames e continuam se enquadrando como possíveis diagnósticos;
B- Se apareceu nova hipótese, que não havíamos pensado, e teremos que refazer o nosso raciocínio clínico.
C- Se os exames estão corretos, bem-feitos, imagens centradas na lesão, com boa qualidade ou teremos que as repetir.
2. As hipóteses de diagnóstico devem ser feitas primeiramente com a clínica, exames laboratoriais e a imagem.
3. A patologia deve ser colocada como uma “ferramenta” para confirmar ou não a suspeita diagnóstica.
Se o exame anatomopatológico revelar um diagnóstico que não estava em nossa lista, deveremos reanalisar o caso, refazer nosso raciocínio. Caso não haja correlação clínica, radiológica e anatomopatológica algo pode estar errado e precisaremos rever conjuntamente, em equipe multidisciplinar, para determinarmos a melhor conduta. Nova biópsia?
4. Para o raciocínio do diagnóstico é preciso primeiramente enquadrar a afecção que estamos analisando dentro dos cinco capítulos da patologia, figuras 1 e 2.
18. Biópsia – conceito – tipos – indicações – planejamento
5. Se concluirmos que nosso paciente apresenta uma neoplasia, precisamos realizar o exercício de raciocínio já descrito nos capítulos de Introdução ao Estudo dos Tumores e Diagnóstico dos Tumores (Links: https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/ e https://oncocirurgia.com.br/diagnostico-dos-tumores/ ).
Após estas etapas é que podemos pensar na biópsia, como “ferramenta” para o diagnóstico definitivo.
Antes de abordarmos o tema “biópsia” vamos analisar alguns casos.
Paciente A: figuras 3 e 4.
Há trinta dias, solicitaram a realização de biópsia de uma lesão da parede abdominal, em paciente internado para investigação.
O médico do paciente encontrou-me na sala de radiologia, analisando a tomografia.
Seguindo o “como eu penso” sobre as lesões perguntei-me: – que estruturas formam a parede abdominal? a. pele (carcinoma espinocelular, basocelular, melanoma); b. subcutâneo (lipoma, lipossarcoma); c. fáscia muscular (fibroma desmóide); d. músculo estriado (fibroma, fibrossarcoma, fibroma desmóide, rabdomiossarcoma); e. vaso (hemangioma, leiomiossarcoma); f. peritônio e cavidade abdominal (já não é minha jurisdição).
Pareceu-me uma extensa lesão e sugeri que procurasse um cirurgião da área, pois eu não saberia conduzir, caso fosse neoplasia maligna. O ideal é que a biópsia seja realizada por aquele que vai operar o paciente.
Relatou-me que o paciente estava ictérico, havia realizados ultrassom e vários exames laboratoriais, insistindo-me a realizar a biópsia. Perguntei-lhe alguns dados e como não sabia informar-me sugeri que passássemos visita no leito. Poderíamos extrair a história clínica e examinar o paciente.
O paciente referiu ser asmático, relatou que o sintoma começou abruptamente após acesso de tosse havia onze dias, em mudança repentina de tempo, com frio e garoa. Apresentou fortíssima dor na parede anterior do abdome, onde apareceu uma “bola”. O abaulamento e a dor estavam diminuindo e a parede lateral tinha endurecido.
Saindo do quarto sugeri que não fizéssemos biópsia, que desse alta para o paciente, que a icterícia com bilirrubina elevada era resultado de um grande hematoma que havia infiltrado a parede lateral, devido à ruptura espontânea do reto anterior do abdome. Esta lesão já estava em reparação e a biópsia apenas mostraria o processo inflamatório cicatricial (com risco de vir miosite proliferativa).
Ainda não convencido, perguntou-me se eu já tinha visto caso de ruptura espontânea do músculo reto abdominal. Respondi não, mas era o que o bom senso dizia. Descendo pela escada encontramos um cirurgião geral e perguntei-lhe sobre o assunto. Este esclareceu que era comum em paciente com bronquite crônica que tomavam corticoide, como era o caso do nosso paciente. A história clínica fez o diagnóstico.
Pacientes B: Figura 5.
No ambulatório a residente pergunta:
– “Por que via de acesso devemos realizar a biópsia?”.
Vejo a imagem e pergunto-lhe: – Qual a idade da paciente?
– “Hum … Dona Maria, quantos anos a senhora tem?”
Reflito em silêncio, avaliando o desconhecimento do aprendiz. A paciente responde 67 anos DOUTOR!
… Sessenta e sete anos, lesões múltiplas, metástase? Mieloma múltiplo? Tumor marrom do hiperparatireoidismo? – Há quanto tempo ela tem os sintomas?
– “Hum … Dona Maria, há quanto tempo a senhora tem esse problema?”
No prontuário vejo anotado sintomas de dor na tuberosidade isquiática, realizado dosagem de Ca++, P++, FA, Na+, K+, eletroforese de proteínas, hemograma, VHS, glicemia, ureia, creatinina, ultrassom, radiografias, …, …
Ao examinar a paciente observo que o “tumor” é anterior, na região inguinal, e não posterior, como estava anotado no prontuário, “tuberosidade isquiática”. A paciente não havia sido examinada!!! Apresentava hérnia ínguino-crural. As imagens da radiografia da pelve representam gases do intestino. A “biópsia” resultaria em perfuração intestinal. O exame físico fez o diagnóstico.
Paciente C: Figura 6.
Passando pelo pronto socorro a plantonista pergunta:
– “Doutor, que tumor o senhor acha que este paciente tem? Podemos agendar a biópsia?”.
Nenhum dado de história o residente sabia relatar e havia feito apenas a radiografia de frente!!! Perguntado, o paciente informa que os sintomas inflamatórios começaram havia seis meses, com dor calor e saída de secreção purulenta. Quando estava aberto, secretando, os sintomas melhoravam. Quando fechava a fístula começava a inchar, doer e tinha febre.
Com dificuldade, pois o paciente muitas vezes sonega informação, soubemos que ele tinha sido ferido na coxa havia dois anos, ao pular a grade de proteção de uma casa, que sangrou bastante, mas não procurou atendimento (história clínica). Pedimos uma radiografia de perfil que comprovou tratar-se de corpo estranho. A ponta da lança da grade estava envolta por reação periosteal sólida, dando a falsa impressão de tumor esclerótico. O exame de imagem adequado confirmou o diagnóstico.
Após estas importantes considerações, vamos estudar o controverso tema da biópsia.
PRECISAMOS:
1- Definir as hipóteses de possíveis diagnósticos, para o nosso caso, primeiramente com a história clínica e exame físico;
2- Realizar os exames laboratoriais e de imagens, para corroborar ou não nossas hipóteses, nosso raciocínio e
3- Somente após estas etapas, poderemos realizar a biópsia, para a patologia “reconhecer a firma” do diagnóstico, previamente pensado com a nossa anamnese, exame físico, laboratoriais e de imagem.
“A anatomia patológica não é caminho curto para o diagnóstico. Devemos correlacioná-la sempre com a clínica, exames laboratoriais e de imagem”.
Quanto à biópsia, podemos subdividir as lesões músculo esqueléticas em três grupos:
- Casos em que o diagnóstico CLÍNICO – RADIOLÓGICO (imagem) é suficiente para o diagnóstico e tratamento, não sendo indicada a biópsia.
- Casos que podem prescindir deste procedimento por dificuldade de diagnóstico histológico, e que pelas características de agressividade clínica e radiológica não se deve alterar a conduta cirúrgica necessária.
- Casos que necessitam da confirmação patológica para tratamento quimioterápico prévio à cirurgia
Vamos discorrer sobre os três grupos, analisando alguns exemplos, figuras a seguir.
GRUPOS 1 e 2: A biópsia não é necessária ou não altera a conduta.
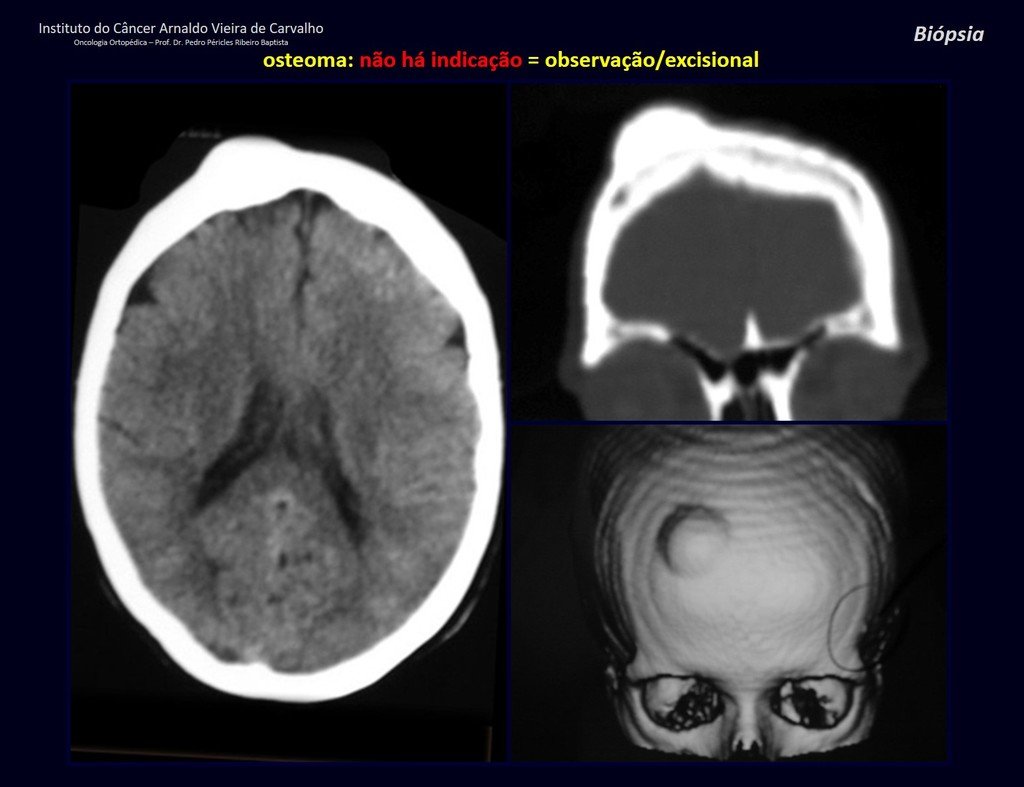
1a. OSTEOMA, figuras 13 a 18.
IDENTIDADE: Lesão neoplásica benigna, bem delimitada, caracterizada por tumor homogêneo, esclerótico e denso, tecido ósseo maduro. É osso dentro de osso.
Estas lesões são bem delimitadas, homogêneas, sem sintomas. São diagnosticadas por achados ocasionais de exames de imagem ou por apresentarem alterações estéticas. Eventualmente podem ser sintomáticos, como num caso que obstruiu a fossa nasal dificultando a respiração. O diagnóstico é clínico e radiológico, não necessitam de biópsia. O tratamento restringe-se à observação e acompanhamento. São raros e eventualmente operados.
1b. OSTEOMA OSTEÓIDE, figuras 19 a 26.
IDENTIDADE: Lesão neoplásica benigna, caracterizada por um tumor circunscrito, com até aproximadamente um centímetro de diâmetro, que apresenta um nicho osteóide central, circundado por halo de esclerose e localizado na cortical dos ossos longos, parte mais compacta.
A região do colo femoral é revestida por um periósteo delgado que não apresenta reação periosteal. Isto dificulta a localização da lesão na cirurgia.
A realização de um orifício na cortical óssea, perto da lesão, guiado por radioscopia, facilitará a operação.
Após esta marcação, fazemos uma tomografia para mensurar a distância do orifício ao centro da lesão, localizando-o. Veja a técnica completa em: http://técnica de ressecção de osteoma osteóide
O osteoma osteóide é uma lesão da cortical óssea. Na coluna vertebral ocorre no pedículo, que é a parte mais compacta, mais dura, assemelhando-se à cortical.
Apresenta um nicho central com halo de esclerose ao redor e não ultrapassa um centímetro.
Não existe “osteoma osteóide gigante”, maior que 1,5 cm, pois nesta situação há erosão da cortical, não há delimitação pelo halo de esclerose e, apesar de poder apresentar histologia semelhante, estamos diante de um osteoblastoma, que é uma lesão benigna, porém agressiva localmente. O osteoblastoma pode ou não estar associado a um cisto ósseo aneurismático e ainda fazer diagnóstico diferencial com osteossarcoma teleangiectásico. Leia também: http://osteoma osteóide
1c. OSTEOCONDROMA, figuras 27 a 32.
IDENTIDADE: É uma exostose em que o osso esponjoso central continua-se com a medular do osso afetado e a camada densa periférica, cortical do tumor, continua-se com a cortical do osso comprometido. Apresenta-se com base alargada, séssil, ou estreita, pediculada. Pode ser único ou múltiplo (osteocondromatose hereditária).
Os osteocondromas são de tratamento cirúrgico quando alteram a estética ou a função, deslocando e comprimindo estruturas vásculo-nervosas, limitando os movimentos ou gerando deformidades angulares. É a lesão óssea benigna mais frequente.
Geralmente crescem enquanto o paciente encontra-se em fase de crescimento. Quando um osteocondroma aumenta de tamanho, depois de terminada a maturidade esquelética pode significar bursite pós-traumática ou malignização para condrossarcoma e deve ser tratado como tal, ressecando-se com margem oncológica.
O osteocondroma solitário apresenta 1% de taxa de malignização. A osteocondromatose múltipla, pode chegar a 10%.
O diagnóstico do osteocondroma é clínico e radiológico e não necessita de biópsia para o seu tratamento.
Leia: http://osteocondroma
1d. CONDROMA, figuras 33 a 50.
IDENTIDADE: Tumor benigno, indolor, formador de cartilagem com focos de calcificação nos ossos curtos das mãos e pés, diagnosticado por acaso ou devido à deformidade ou fratura. Pode ser solitário ou múltiplo (encondromatose, síndrome de Maffucci, doença de Ollier).
Nos dedos das mãos e dos pés, as lesões cartilaginosas geralmente têm comportamento benigno.
A eventual evolução indesejada para um condrossarcoma, de uma cirurgia de curetagem nestas localizações, não compromete a possibilidade de cura, pois a ressecção completa do dedo, que é o tratamento do condrossarcoma, continuaria sendo possível.
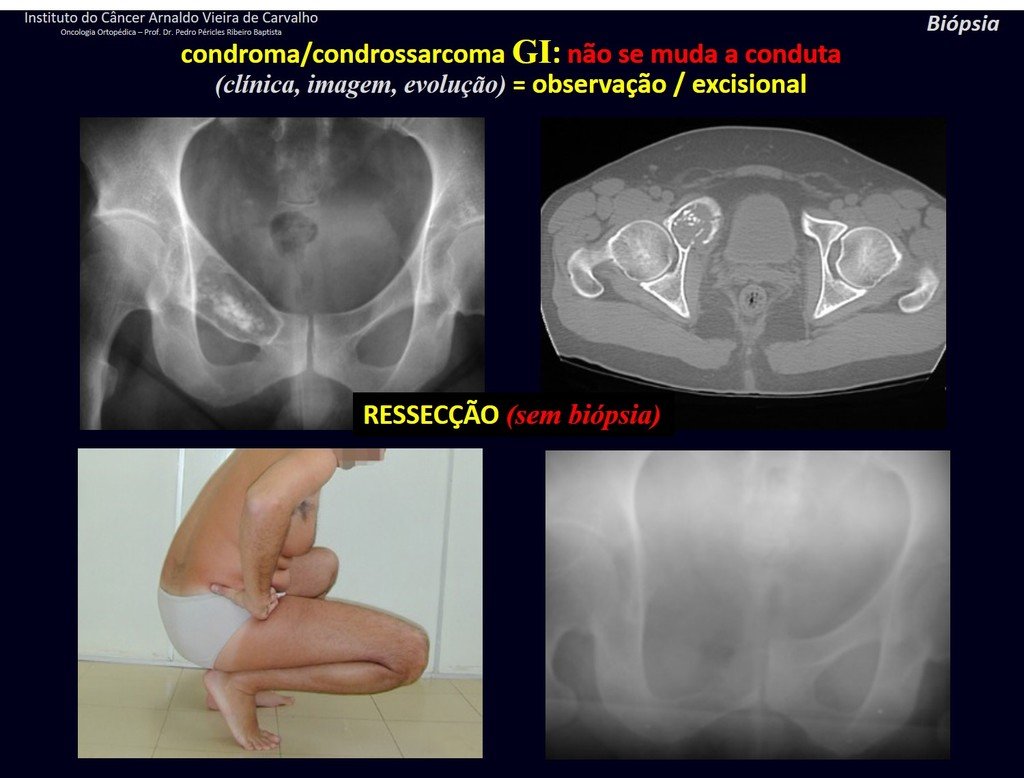
CONTROVÉRSIA: CONDROMA OU CONDROSSARCOMA GRAU I?
O condroma ocorre eventualmente na metáfise dos ossos longos (fêmur distal, úmero e tíbia proximal) e raízes dos membros (ombro, pelve). Nestes casos, pode confundir-se com infarto ósseo ou condrossarcoma grau I.
Nos achados ocasionais, como o diagnóstico anatomopatológico entre condroma e condrossarcoma grau I é controverso, é preferível não realizar a biópsia e acompanhar clínica e radiograficamente se há evolução.
O condrossarcoma grau I é de evolução lenta, o que permite este acompanhamento, possibilitando a observação para o diagnóstico seguro da sua atividade ou não.
Repete-se os exames com um, três e seis meses, e depois anualmente. O tumor deve ser tratado cirurgicamente como condrossarcoma em qualquer momento, se a comparação entre as imagens revelar alteração da lesão.
Caso a lesão continue inalterada, a melhor conduta é continuar acompanhando. Alguns pacientes questionam até quando? A resposta é: – Sempre. A reavaliação deverá continuar de qualquer forma, quer o paciente seja operado ou não.
Tratar uma lesão, assintomática, achado casual, sem mudança de imagem com cirurgia menor é “overtreatment”, o qual também precisará de acompanhamento ou pior, caso o anatomopatológico revelar histologia maligna.
Exemplificando esta conduta, vamos analisar o seguinte caso, acompanhado há 14 anos, figuras 39 a 42.
CONDROMA ou CONDROSSARCOMA? Nestes casos o bom senso deve prevalecer, ele nos adverte que o papel aceita qualquer escrita.
Devemos nos basear no comportamento clínico da lesão. Houve ou não alteração? De uma eventual biópsia, que se optar por realizar, só poderemos acrescentar que se trata ou não de uma “lesão cartilaginosa”. Não podemos mudar a nossa conduta: OBSERVAR OU OPERAR COMO CONDROSSARCOMA. Por segurança, se optarmos por operar, devemos tratar cirurgicamente como condrossarcoma, que é a nossa única “ferramenta”, pois não respondem à quimioterapia nem à radioterapia.
Continuando, analisemos as figuras 43 a 50.



A mensagem que pretendemos deixar é:
¨O médico pode realizar a biópsia, pois é uma conduta acadêmica, que lhe dá mais respaldo quanto a ser uma lesão cartilaginosa. Mas não deve operar com técnica de curetagem, como condroma, pois os condromas latentes dos ossos longos, achados casuais não requerem tratamento cirúrgico e sim observação. A biópsia atrapalha esta observação pois não saberemos se a dor e alteração da imagem, que eventualmente ocorrer posteriormente à biópsia, seria devido a agressão da biópsia ou se é um condrossarcoma manifestando-se. Concluindo, se o médico optar por intervir, deve operar como condrossarcoma. Lembramos ainda que a cirurgia, realizada por qualquer técnica, não eliminará a necessidade de observação e acompanhamento¨.
1e. CONDROBLASTOMA, figuras 51 a 54.
IDENTIDADE: Lesão neoplásica epifisária benigna, do esqueleto em crescimento, (1a e 2a décadas), caracterizada por rarefação óssea, erosão da cartilagem articular com insuflação, células cartilaginosas (condroblastos), células gigantes e focos de calcificação.
1f. CISTO ÓSSEO SIMPLES – C.O.S. , figuras 55 a 58.
IDENTIDADE: Lesão pseudoneoplásica, unicameral, circundada por membrana, bem delimitada, preenchida com líquido seroso, de localização metafisária central, que não ultrapassa a sua largura e ocorre em crianças e adolescentes.
Leia: http://cisto ósseo simples
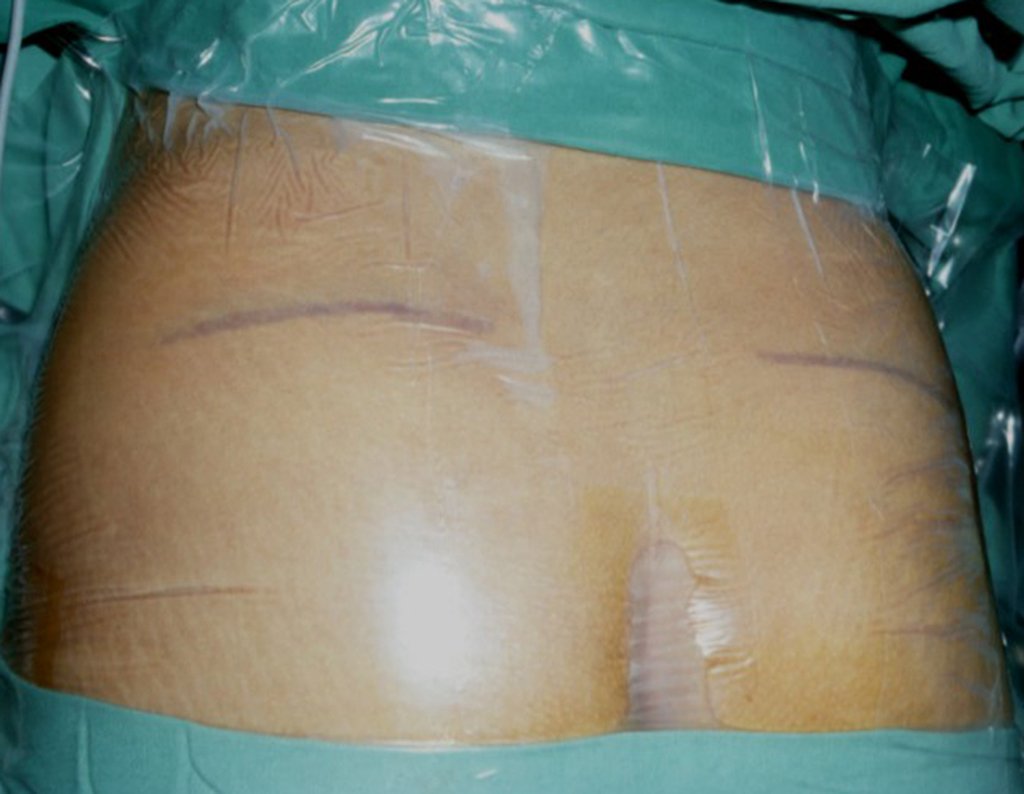
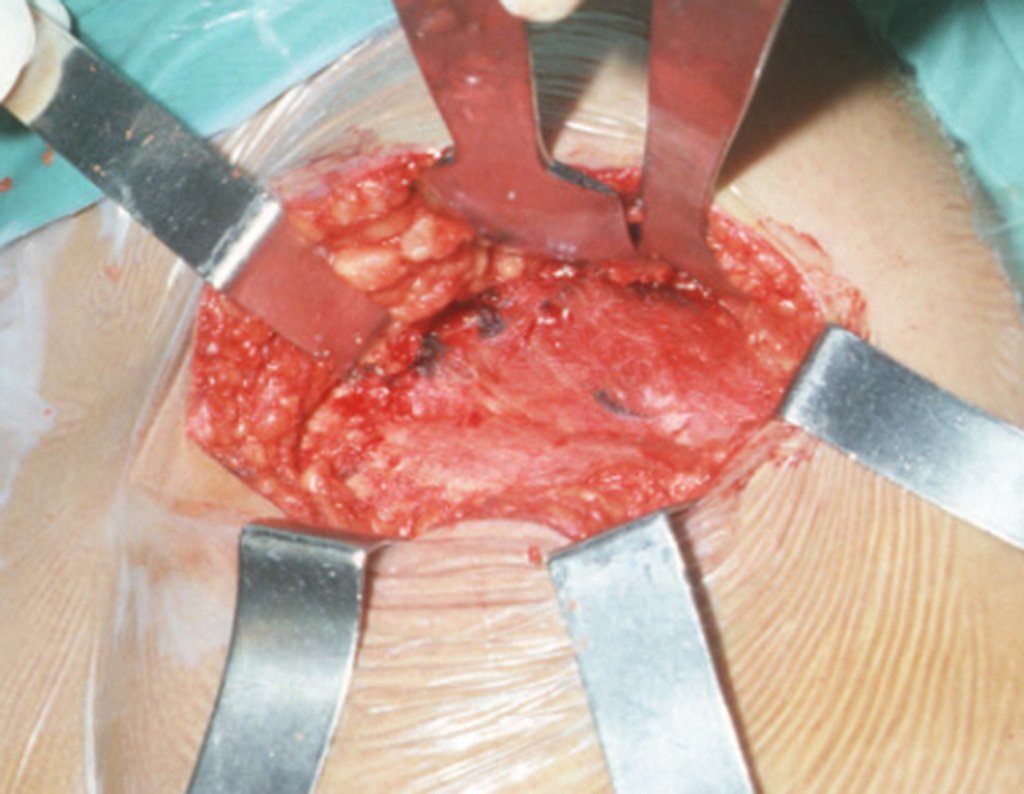
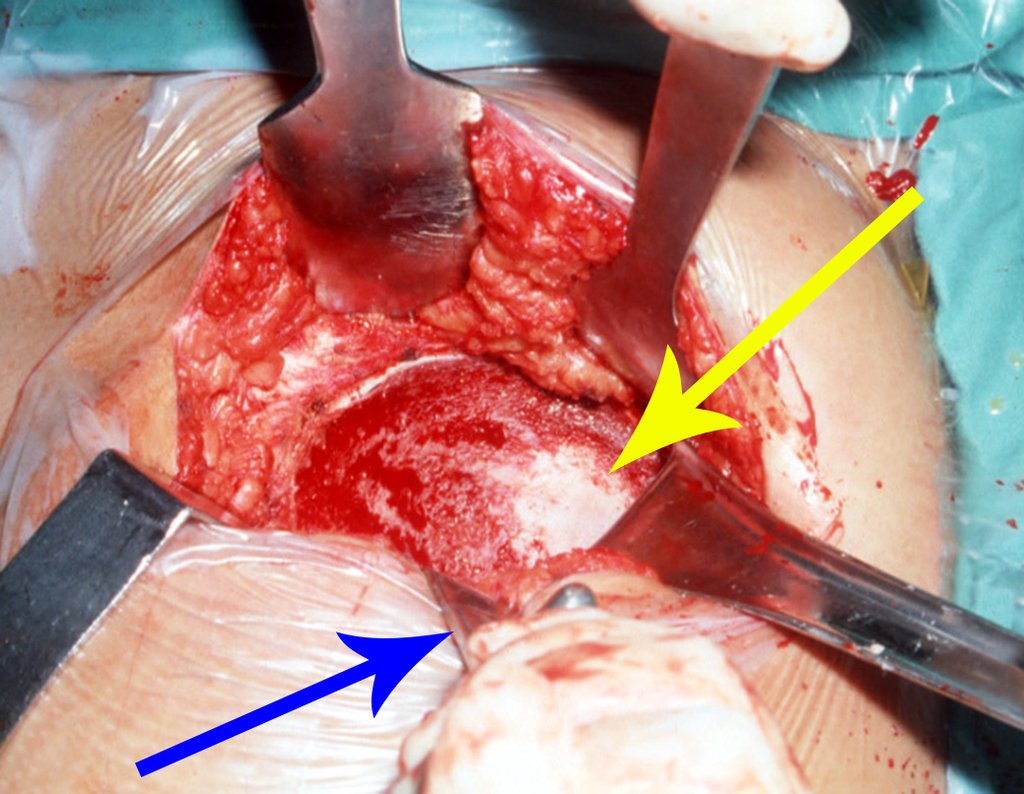
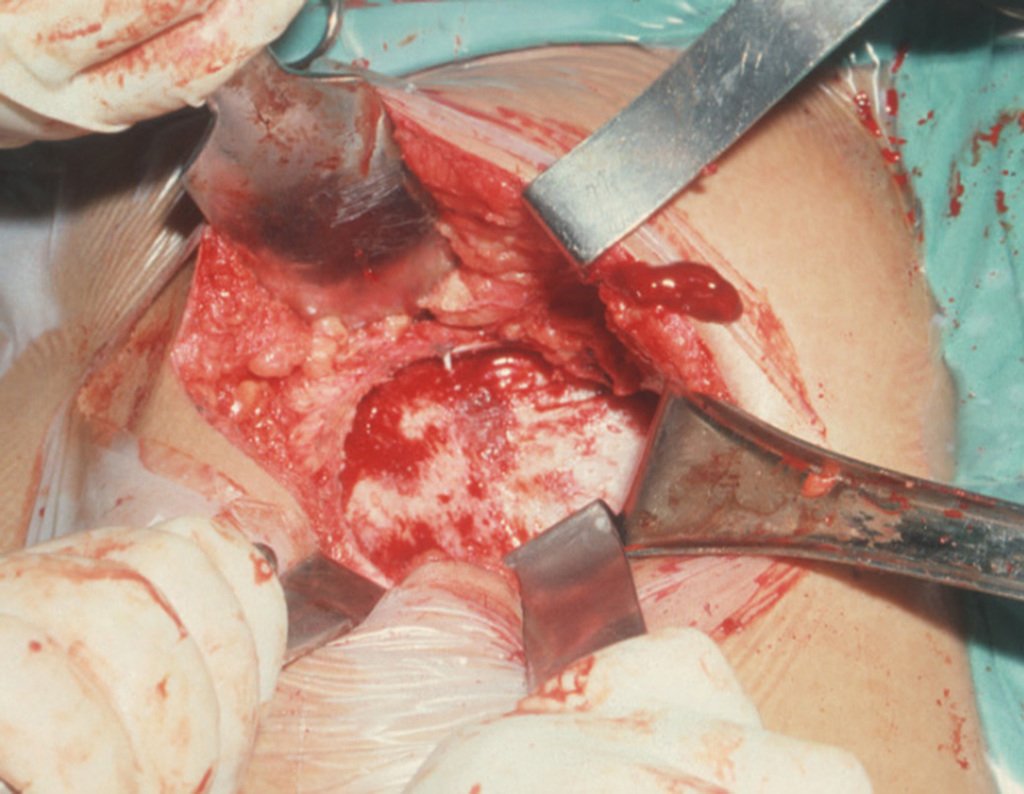
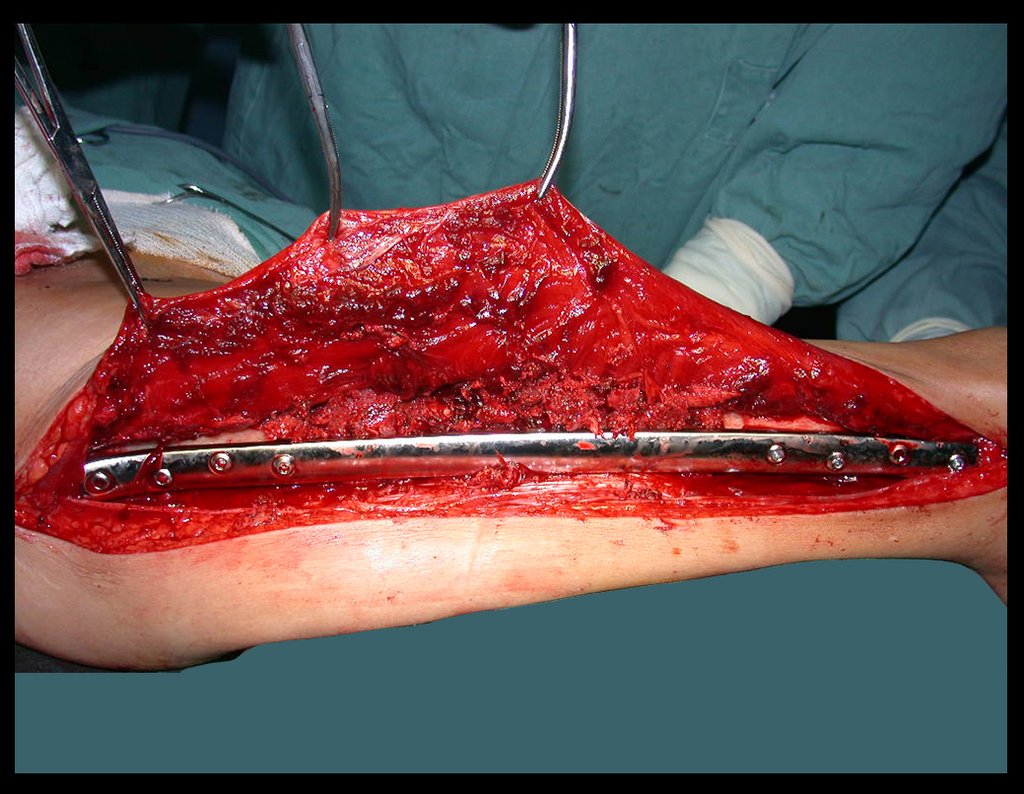
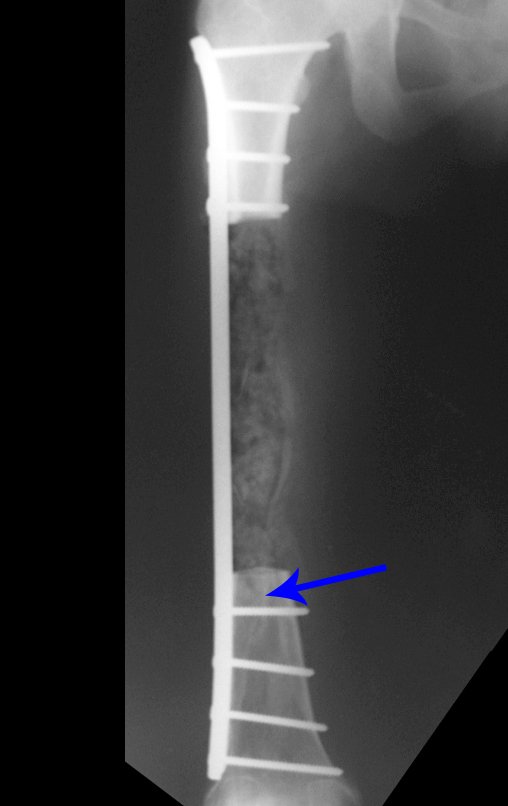
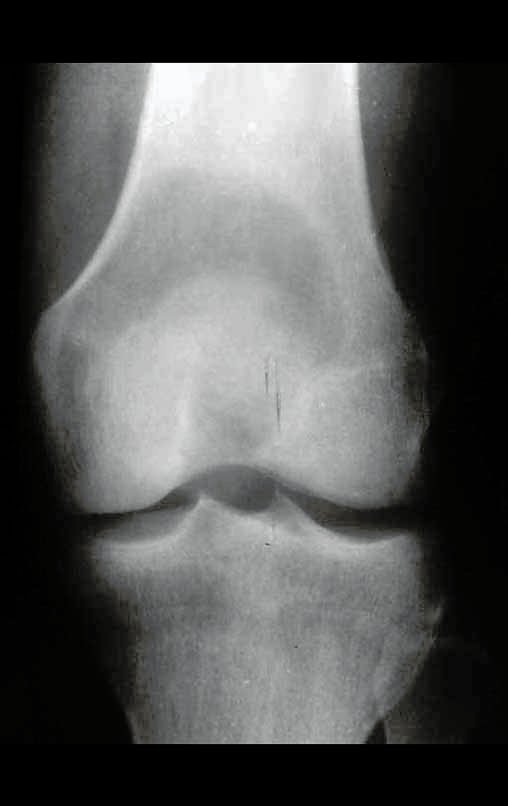
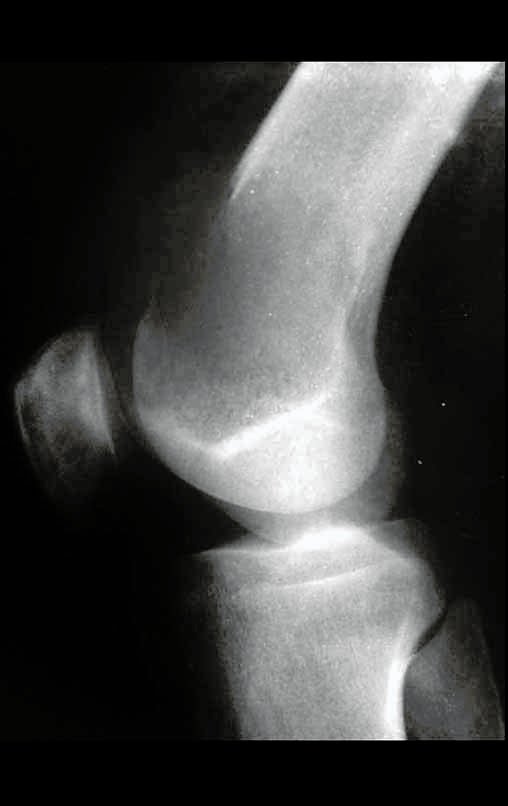
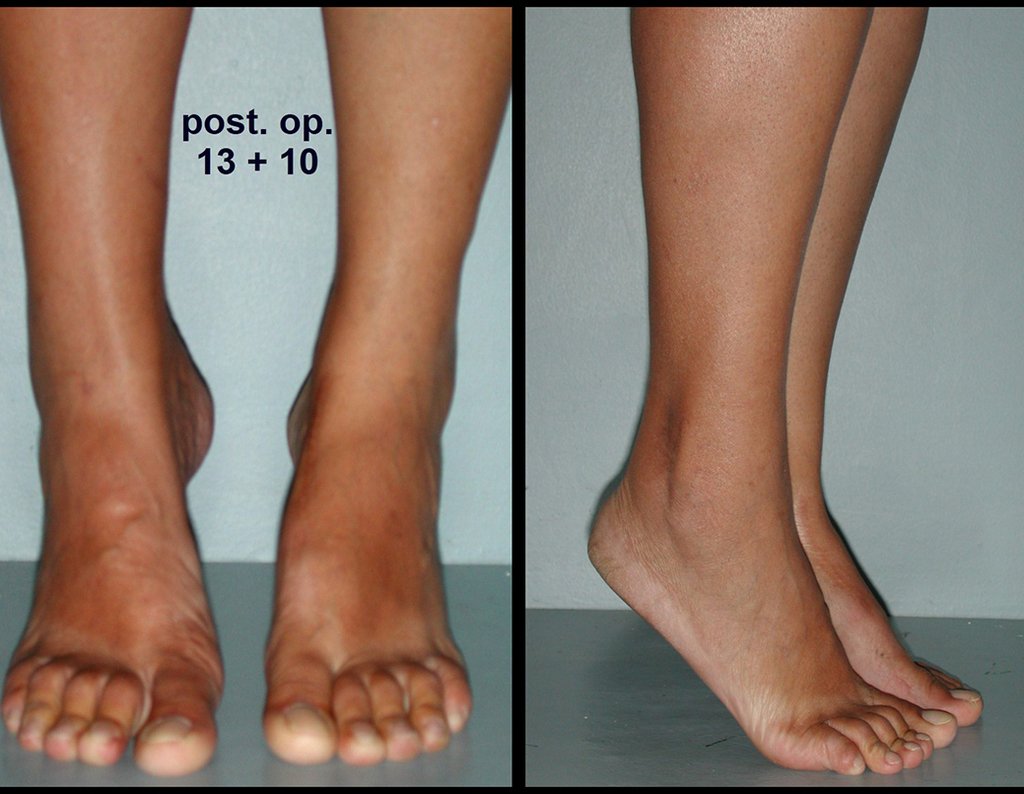
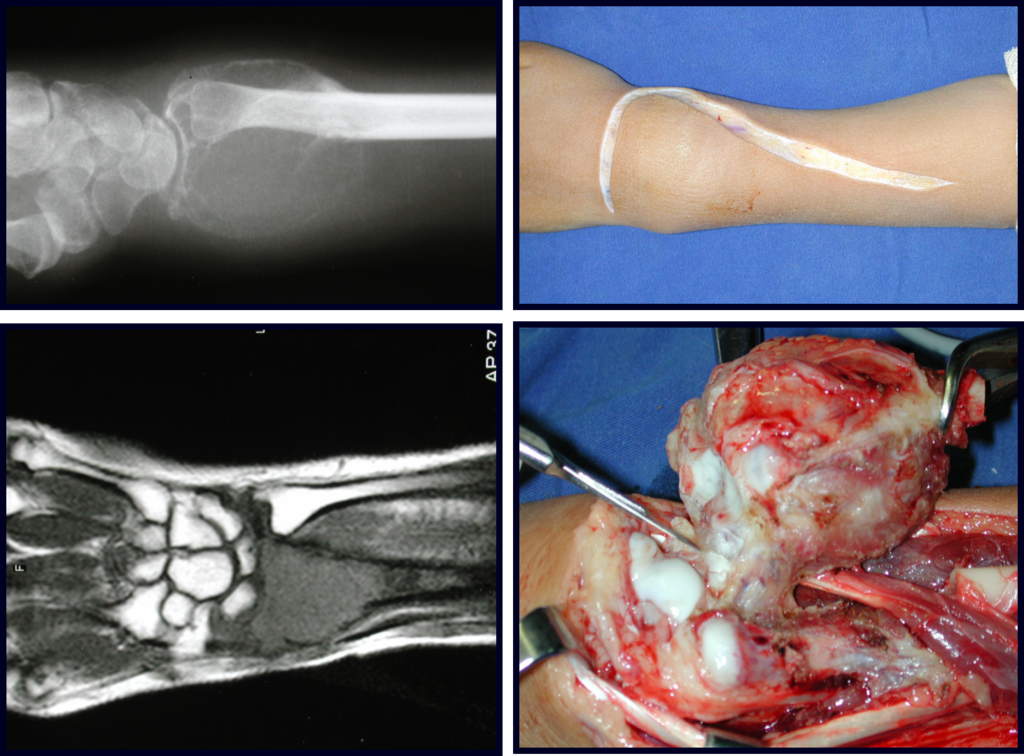
1g. CISTO ÓSSEO JUSTAARTICULAR – GANGLION, figuras 59 a 62.
IDENTIDADE: Lesão pseudoneoplásica, de localização epifisária, unicameral, circundada por membrana sinovial, bem delimitada e preenchida com líquido seroso, que se comunica com a articulação adjacente.
Estas lesões não requerem a realização de biópsia para o tratamento.
1h. DEFEITO FIBROSO CORTICAL / FIBROMA NÃO OSSIFICANTE, figuras 63 e 64.
IDENTIDADE: Lesão pseudoneoplásica na cortical óssea de limites precisos, assintomática. Achado ocasional.
1i. DISPLASIA FIBROSA DA TÍBIA / OSTEOFIBRODISPLASIA, figuras 65 a 70.
IDENTIDADE: Lesão pseudoneoplásica na diáfise da tíbia com rarefação óssea de densidade intermediária, como se o osso tivesse sido “apagado”, aspecto de vidro fosco. Pode ocorrer em mais de uma localização. Sua evolução é variável podendo causar deformidade, desdiferenciar-se ou ter um crescimento harmônico, estabilizando-se na maturidade esquelética.
1J. MIOSITE OSSIFICANTE, figuras 71 e 72.
IDENTIDADE: Lesão localizada próxima de um osso e em tecidos moles, relacionada a traumatismo pregresso, cuja ossificação inicia-se na periferia.
1k. TUMOR DE TECIDOS MOLES – ALGUNS, figuras 73 a 78.
IDENTIDADE: Lesões delimitadas, homogêneas, com imagens típicas, sem captação de contraste ou com captação apenas na periferia, podem ser operadas sem biópsia prévia, quando a conduta cirúrgica não seria diferente, mesmo em tratando-se de neoplasia maligna.
Os tumores malignos de tecidos moles teriam o mesmo procedimento de ressecção cirúrgica, com as margens exíguas apresentadas no caso acima e seriam complementados com radioterapia local. Os sarcomas de tecidos moles, até o presente momento, não respondem a quimioterapia nem apresentam melhora no índice de sobrevivência do paciente.
Uma eventual biópsia poderia provocar lesão nervosa e não mudaria a conduta.
A biópsia pode ser realizada, é acadêmica, complementa os estudos do caso, mas a conduta cirúrgica de ressecção deve prevalecer, mesmo em se tratando de neoplasia maligna. Os sarcomas de tecidos moles, até o presente momento, não se beneficiam com tratamento neoadjuvante e a cirurgia ablativa não altera a sobrevivência.
GRUPOS 3: A biópsia é necessária para o tratamento (cirurgia; com/ sem neoadjuvancia)
Precisamos ressaltar que a biópsia deve ser executada/acompanhada pelo cirurgião que vai realizar a cirurgia. Sua presença é essencial para que esta seja realizada de acordo com o planejamento da cirurgia.
Não se deve realizar incisões transversas, nem incisões extensas onde não há musculatura para posterior cobertura, como na perna por exemplo. A sutura não deve ter pontos distantes da incisão, pois isto exigirá uma ressecção mais larga de tecido e muito menos realizar-se mais de uma incisão, figuras 79 (quadros A, B, C e D) e 80.
Veja o caso completo da figura 80 em: http://tgc-prótese intraepifisária
A seguir, exemplificamos dois casos de biópsias realizadas corretamente, figuras 83 a 86.
*Veja o caso completo da figura 83 e 84 em: http://transplante de cartilagem de crescimento
*Veja o caso completo da figura 85 e 86 em: http://prótese parcial rotatória
PLANEJAMENTO E EXECUÇÃO DAS BIÓPSIAS: CONSIDERAÇÕES – COMO EXECUTAR
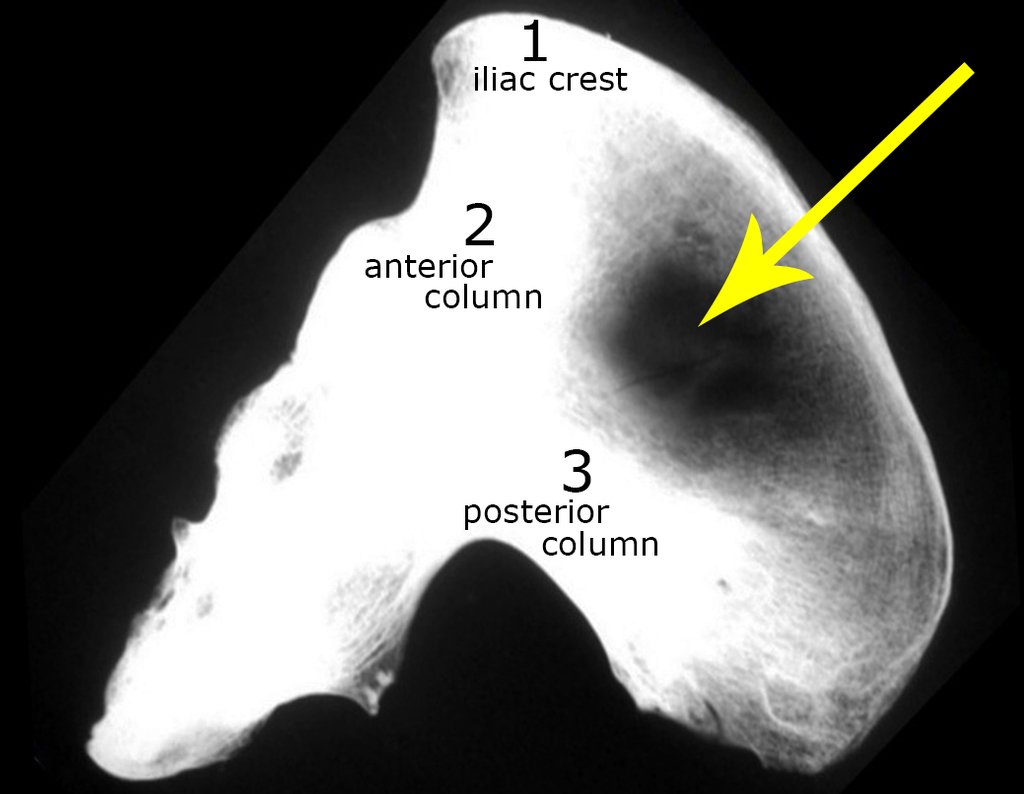
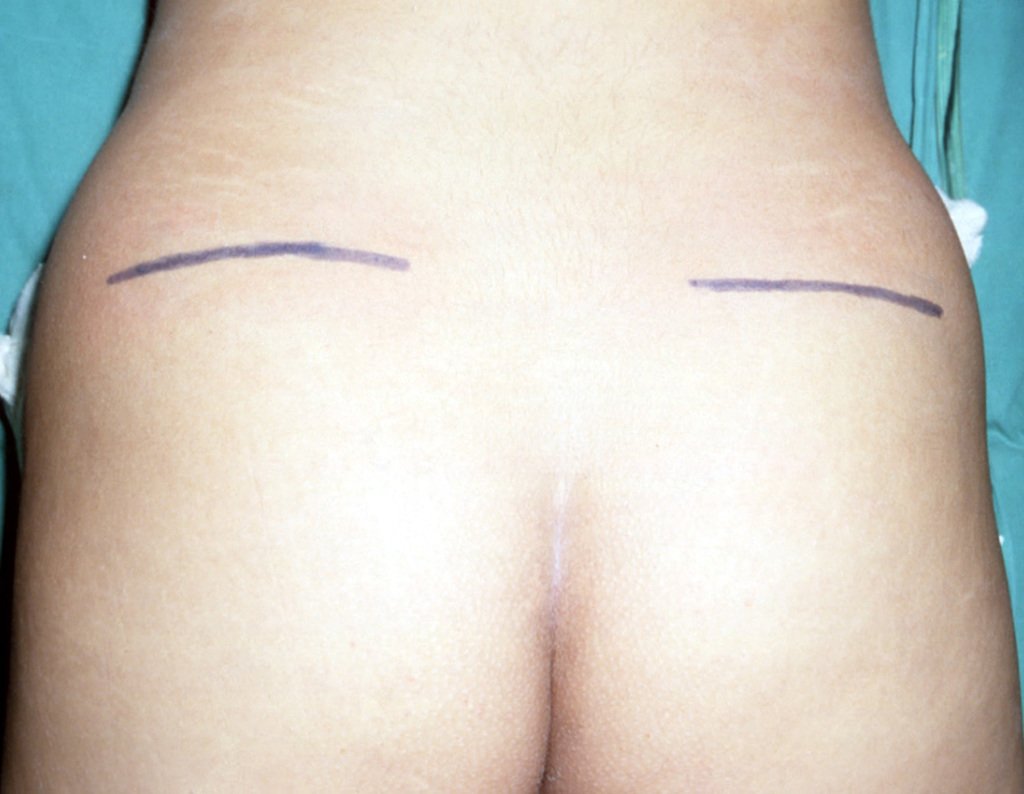
Considerações do Caso 1: Vamos descrever como procedemos nesta paciente feminina, 40 anos de idade, dor na crista ilíaca póstero superior a direita, havia seis meses, figuras 87 a 116.
Na análise da ressonância estudamos o comprometimento da lesão, planejamos o acesso cirúrgico e a tática de ressecção com margem, para então escolhermos o trajeto mais adequado e seguro para a nossa biópsia, figuras 91 e 92.

Assim a ressecção planejada é de se acessar por incisão seguindo pela crista ilíaca, dissecando externamente pelo plano gorduroso e internamente descolando o peritônio. Pretendíamos colocar a paciente em decúbito dorsal, mas enquanto paramentava a paciente foi anestesiada e posicionada em decúbito prono, o que dificultava o procedimento, a nosso ver, figuras 93 e 94.
O operador de Rx argumentou que aquela posição era a melhor e que conseguiríamos facilmente o material para o estudo histológico e … fez um X por onde iria obter a amostra! Figuras 95 e 96.
Expliquei-lhe que não deveríamos mudar a direção da incisão cirúrgica planejado, pois isto dificultaria o acesso interno à pelve. Orientamos para puncionar no ponto lateral da crista, apesar da dificuldade de angulação da agulha, devido ao decúbito prono. Este procedimento é descrito como ¨biópsia de congelação¨, figuras 97 a 102.
Com a confirmação de tumor cartilaginoso, provável condrossarcoma GII, realizamos a ressecção parcial da pelve direita, conforme planejado, sem neoadjuvancia, figuras 103 a 116.
Video 1: Exposição da face interna da pelve e osteotomia delicada, realizada com brocas minimamente invasivas.
Considerações do Caso 2: Vamos agora discutir a biópsia neste paciente com onze anos de idade, com dor e tumor na coxa esquerda havia duas semanas. Provável osteossarcoma, figuras 115 a 118.
Vemos, com muita frequência, pacientes com cicatrizes de biópsia realizadas na região ântero-lateral da metáfise distal do fêmur. A seta vermelha aponta a fáscia lata, que na maioria das vezes é interrompida pelo trajeto da biópsia, realizada por profissionais que não vão operar o paciente, dificultado a cobertura da futura cirurgia e a função deste membro que precisará ser reconstruído.
A seta amarela indica o trajeto póstero-lateral, mais adequado para a biópsia e para a reconstrução, propiciando a melhor cobertura e função.
Para a realização da biópsia por este trajeto o posicionamento adequado do paciente é em decúbito prono, figuras 119 a 122.
O tratamento de tumores da extremidade distal do fêmur, como esta lesão, com este grau de comprometimento e localização, indicamos a biópsia conforme descrevemos e a realização de quimioterapia neoadjuvante de indução, ressecção com margem oncológica e reconstrução com prótese modular e quimioterapia adjuvante.
O paciente deste exemplo está fora de tratamento, com excelente função, podendo-se ver o caso completo no Link: http://osteossarcoma-discrepância de comprimento .
A realização de biópsia musculoesquelética, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes
“A realização de biópsias musculoesqueléticas, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes e com a participação do cirurgião que estará conduzindo o caso”.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
O enxerto ósseo autólogo é utilizado em várias situações na ortopedia, na traumatologia e principalmente nas reconstruções das cirurgias oncológicas ortopédicas.
Nas falhas ósseas, ele é seguramente o que promove a melhor e mais rápida consolidação óssea, tem a melhor integração e mais rápida remodelação.
Em segundo lugar podemos recorrer ao enxerto ósseo homólogo, osso de banco de tecidos, obtido de cadáver, que apresenta o inconveniente da antigenicidade, tem maior índice de infecção, maior demora para incorporar-se e no processo de integração pode ocorrer fragilidade estrutural. Por último podemos citar os produtos artificiais liofilizados, que pretendem ser osteo indutores.
O nosso objetivo é divulgar a técnica que utilizamos para a obtenção da maior quantidade de enxerto ósseo com a menor morbidade.
Acreditamos que, sempre que for possível utilizar o enxerto autólogo, estaremos disponibilizando a alternativa que permite o melhor resultado.
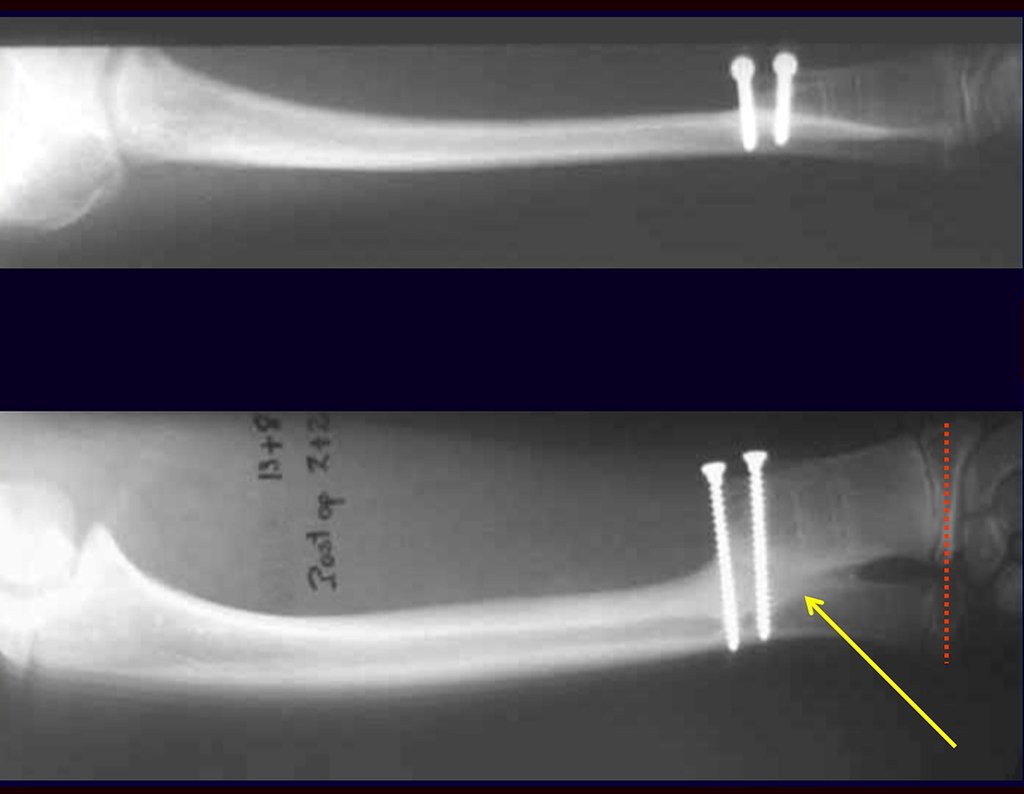
Quando necessitamos de pequena quantidade de enxerto não questionamos muito a sua indicação. Como exemplo, em caso da necessidade de ressecção dos 3/4 proximais do rádio, devido a lesão tumoral, que pretendemos solucionar com a realização de uma “sinostose” radio-ulnar distal, figuras 1 a 4.
01. Enxerto ósseo autólogo – Técnicas de obtenção
Quando necessitamos Reconstrução com cruentização da sindesmose radio ulnar distal, interposição de enxerto ósseo autólogo e fixação com dois parafusos Inter fragmentários, figura 2.
Após três anos da realização da sinostose radio ulnar distal, podemos verificar a consolidação, a total integração do enxerto e observar que as fases do rádio e da ulna continuam com crescimento simétrico, com boa função, figuras 3 e 4.
Há três décadas atuamos no Instituto do Câncer Dr. Arnaldo Vieira de Carvalho, o primeiro Hospital do Câncer do Brasil, completando 95 anos neste ano de 2016, figura 5 e 6.
A necessidade de se obter enxerto em quantidade, para viabilizar as grandes reconstruções biológicas, fizeram-nos aprimorar a técnica cirúrgica para obter enxerto autólogo com menor morbidade e em significativa maior quantidade.
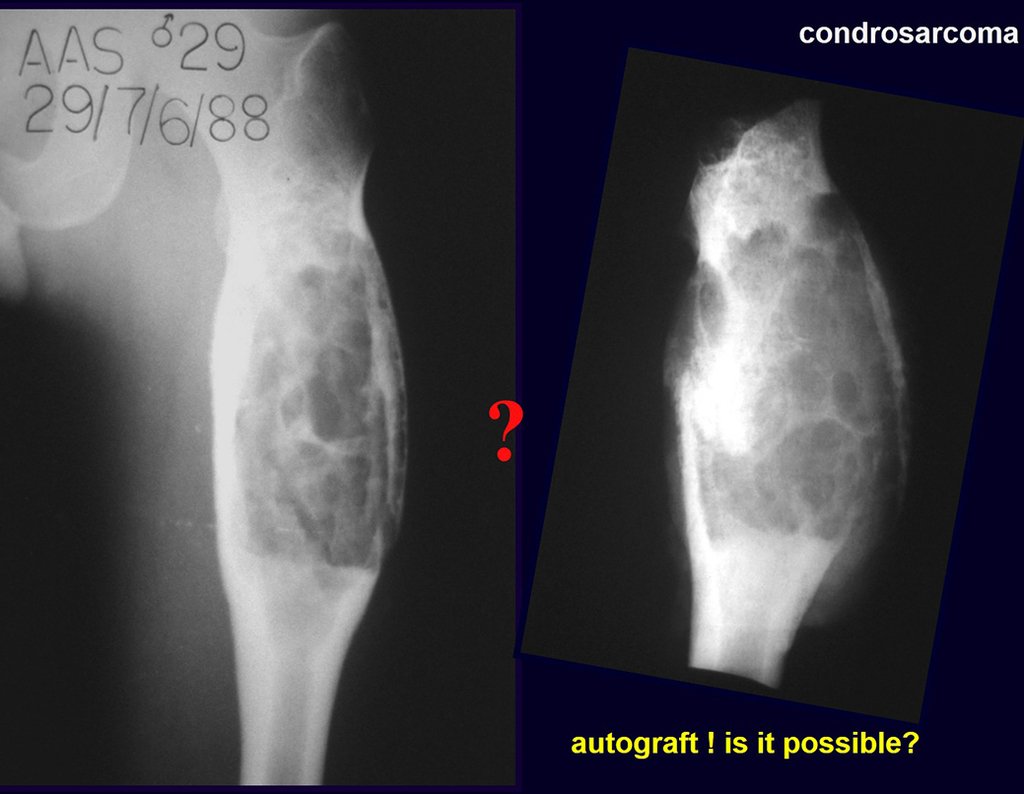
É possível obter enxerto ósseo autólogo para preencher uma grande falha óssea, de apenas uma tábua interna do ilíaco, como a da figura 7? Vamos demonstrar que sim, é possível, figura 8.
Vídeo 1: Podemos obter enxerto autólogo em quantidade do osso ilíaco, tanto quanto a abundante água deste riacho. – Algonquin Park Ontário Canadá.
O enxerto obtido deverá ser aplicado na reconstrução de forma a evitar a formação de linhas de pseudo artrose, que será explicado posteriormente.
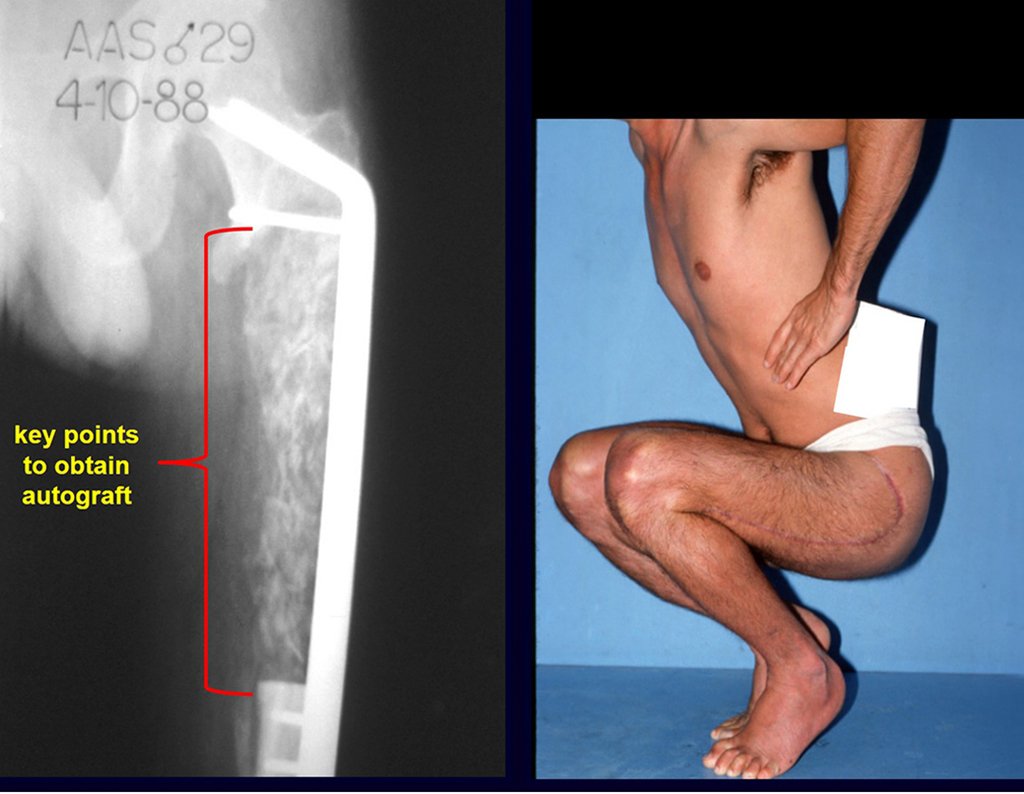
Os pontos chaves e a técnica para uma boa obtenção de enxerto do osso ilíaco são descritos nas figuras X à Y.
É necessário um amplo acesso, por sobre a crista ilíaca, desde a espinha póstero superior até a espinha ilíaca anterossuperior. A incisão deve ser superficial, apenas na pele e tecido subcutâneo, para não lesar o nervo sensitivo fêmur cutâneo lateral. Antes de prosseguir na dissecção, realizamos cuidadosa cauterização dos vasos do subcutâneo com o eletro cautério. figuras 9 e 10.
Nesta fase, com o descolamento do fino periósteo, há um grande número de vasos nutrícios que começam a fluir sangue. Estes devem ser obliterados com hemostático de tecidos ósseos, visando tamponá-los. Precisamos reparar que há uma pequena área do ilíaco em que as tábuas externa e interna estão muito próximas, quase fundidas. Nesta pequena “ilha” não há enxerto (assinalada pela seta em amarelo), figura 15.
Após esta hemostasia adequada, colocamos a ponta de uma compressa na incisura ciática maior e deixamos por sobre a sacro-ilíaca, para represar o sangue e o enxerto. Iniciamos com um osteótomo a retirada da cortical superior da crista ilíaca. Devemos iniciar a retirada de enxerto com a hemostasia controlada, figura 16.
Com osteótomos curvos e afiados, modelados na anatomia da região, retiramos a cortical interna em camada a mais fina possível. A exposição do tecido esponjoso possibilita que o sangue escorra. Este sangue não deve ser aspirado, deve-se deixar que fique sendo coletado no fundo, formando um coágulo. Este sangue coletado possui células toti potentes. Ele será colhido com uma compressa e colocado numa cuba onde armazenaremos o enxerto obtido, nutrindo e conservando-o, figuras 17 a 19.
Após a retirada de toda a cortical interna, guardamos o enxerto em uma cuba, embebido pelo coágulo coletado, conservando assim as células totipotentes, que também serão colocadas na falha óssea. A seguir, com um formão afiado e SEM utilizar o martelo, prosseguimos com a retirada do osso esponjoso do ilíaco, figuras 20 à 23.
Com este cuidado na coleta do enxerto, sem o uso de martelo, realizando a “raspagem” da tábua interna, já descortica lizada, não perfuramos o osso e mantemos ao máximo anatomia do ilíaco, figura 24. O enxerto obtido é colocado em uma cuba juntamente com o sangue coletado, preservando por embebição a nutrição das células totipotentes, figura 25. Este enxerto deve ser arrumado, misturando-se o material de osso cortical obtido com a parte esponjosa, para serem apostos na falha óssea, figura 26. Nas falhas segmentares, devemos obter lascas e entrelaçá-las, fazendo uma amarração, como o pedreiro assenta os tijolos na edificação de uma parede, evitando-se a formação de traços de pseudoartrose, figura 27.
Reparem nas figuras 28 e 29, radiografia e foto do ilíaco, a evidência da inexistência de enxerto na zona apontada pelas setas amarelas. Na radiografia a área de rarefação e a transparência desta região destacada pela trans iluminação.
Quando o paciente precisa ser posicionado em decúbito prono, como nas cirurgias da coluna vertebral, podemos obter enxerto autólogo, com maior facilidade, expondo a da tábua do ilíaco.
Nesta abordagem, a melhor incisão é a horizontal, na altura da espinha ilíaca póstero superior. Esta incisão é mais cosmética, podendo ser ocultada facilmente por um biquini, além de facilitar tanto a exposição da crista ilíaca, quanto da coluna posterior, figuras 30 e 31.
Incisamos a pele e tecido celular subcutâneo, realizamos cuidadosa hemostasia e descolamos por sobre o perimísio do músculo glúteo máximo. Colocamos afastadores de Hohmann apoiados na crista ilíaca e rebatendo o subcutâneo superiormente, Figura 32. O mesmo descolamento é feito distalmente e apoiamos um afastador de Bennet na incisura isquiática maior e retiramos a cortical externa, figura 33.
Raspamos o osso esponjoso com formões afiados, retiramos o enxerto da região sacro-ilíaca, crista e coluna posterior. Realizamos a hemostasia dos vasos nutrícios com cera para osso, figura 34. O enxerto obtido é picado em forma de finos palitos, para facilitar a reabsorção e a reintegração, figura 35.
É importante recordar o conceito da reparação das falhas ósseas com enxerto ósseo: EM UMA RECONSTRUÇÃO BIOLÓGICA, TODO ENXERTO ÓSSEO COLOCADO PARA PREENCHER CAVIDADES OU FALHAS SEGMENTARES PASSA POR UMA FASE DE REABSORÇÃO PARA POSTERIORMENTE SER REINTEGRADO, REPARANDO A PERDA ÓSSEA. O enxerto deve ser entrelaçado e ir além do nível da osteotomia, evitando-se pseudoartroses, como exemplifica este caso de condrossarcoma nas figuras 36 a 38, setas azuis.
A seguir, apresentamos um exemplo de reconstrução de cavidade, em caso de tumor de células gigantes, tratado com curetagem intra-lesional, adjuvante com eletrotermia, frisagem com esfera odontológica e preenchimento com enxerto ósseo autólogo, retirado da tábua interna de um ilíaco. Total integração do enxerto e excelente função do joelho operado, figuras 39 a 49.
O osso ilíaco é também fonte rica de enxerto estrutural, com melhor qualidade quanto à integração do que a fíbula. A obtenção deste tipo de enxerto deforma o contorno anatômico da pelve, pois há necessidade de retirar a crista ilíaca conjuntamente com a cortical interna e externa, formando um bloco triangular, conforme exemplificam os casos de cisto ósseo simples, mostrados nas figuras 50 a 60.
Vídeo 2: Aspecto estético e funcional. Boa reconstrução, anatômica, e boa função de flexão com carga total.
Outro exemplo de emprego de enxerto estrutural pode ser observado neste caso de reconstrução do primeiro metatarso, devido à lesão por tumor de células gigantes, figuras 57 à 60.
Vídeo 3: Boa estética e função, após 22 anos da cirurgia.
Este caso pode ser visto na íntegra acessando o link: http://bit.ly/sarcoma-de-Ewing
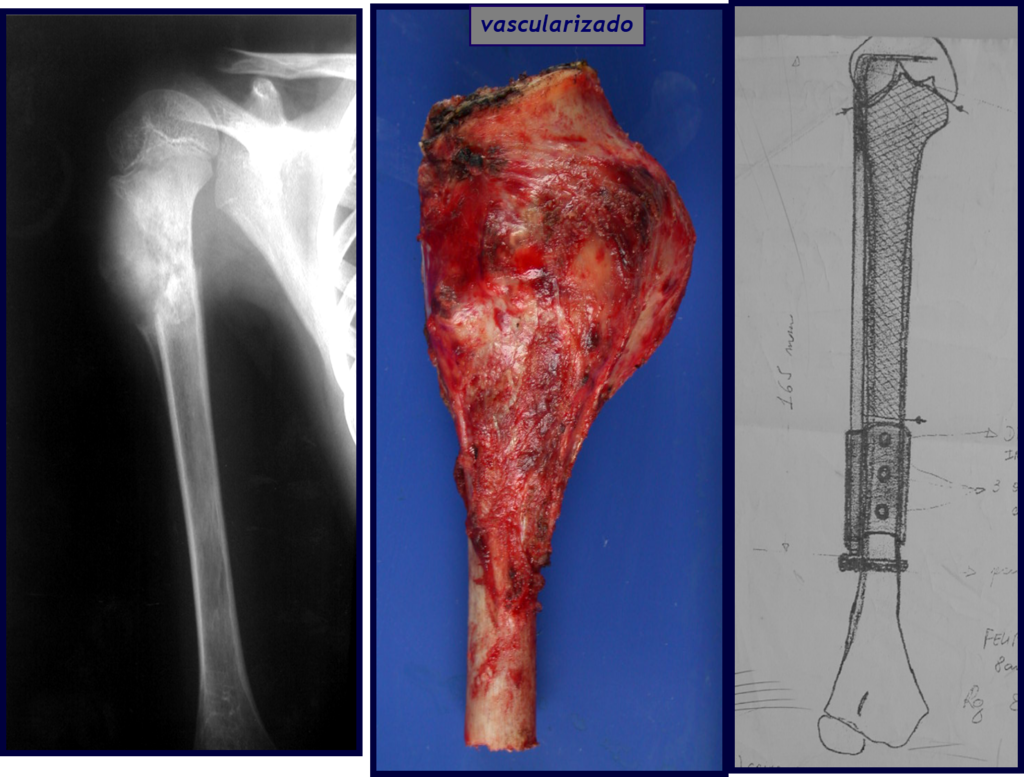
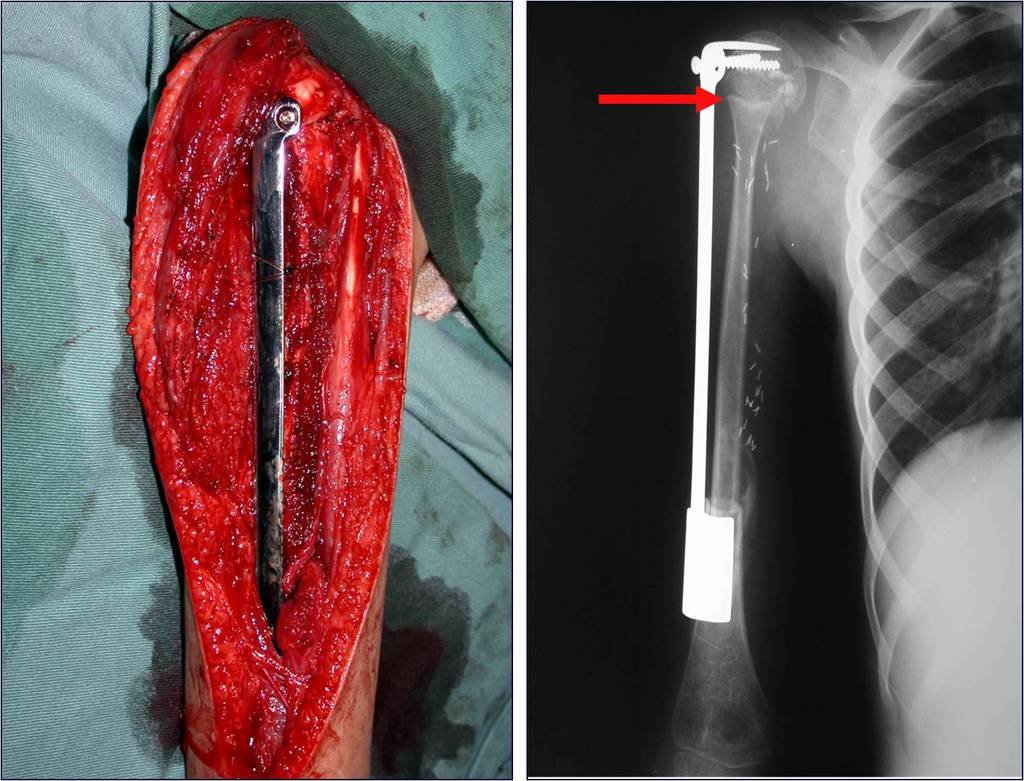
A fíbula também pode ser empregada vascularizada nas reconstruções, inclusive com a placa de crescimento para substituir a que será ressecada devido ao tumor. É um autotransplante de fíbula com a placa fisária, realizando-se a osteossíntese com o dispositivo de fixação interna extensível, figuras 63 e 64.
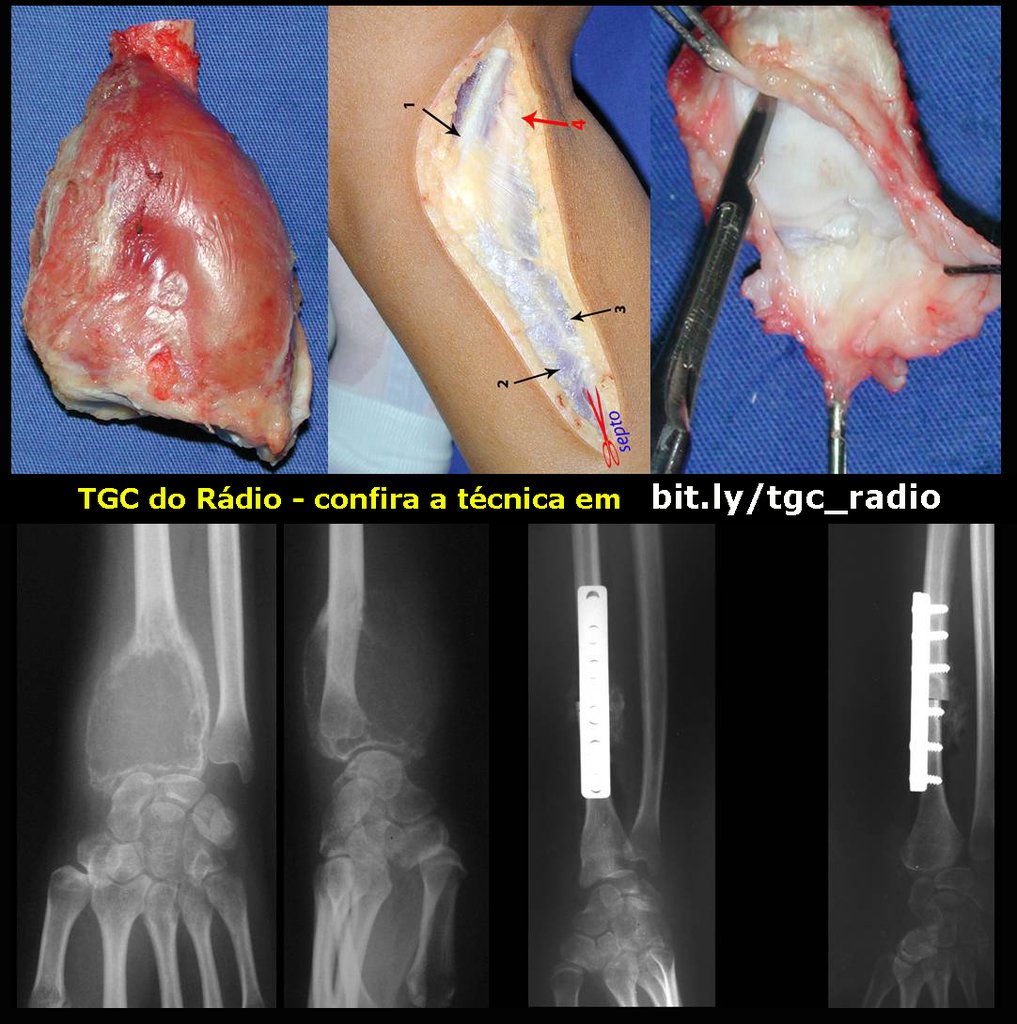
Na reconstrução de pequenos segmentos, como em reconstrução do rádio, por traumas ou tumores, podemos empregar a fíbula livre com bons resultados, figuras 65 e 66.
Este caso pode ser visto na íntegra acessando o link: http://bit.ly/tgc_radio
Ainda em reconstruções da pelve, figura 67
Outra fonte de enxerto são os côndilos femorais ou tibiais, figuras 69 e 70.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com