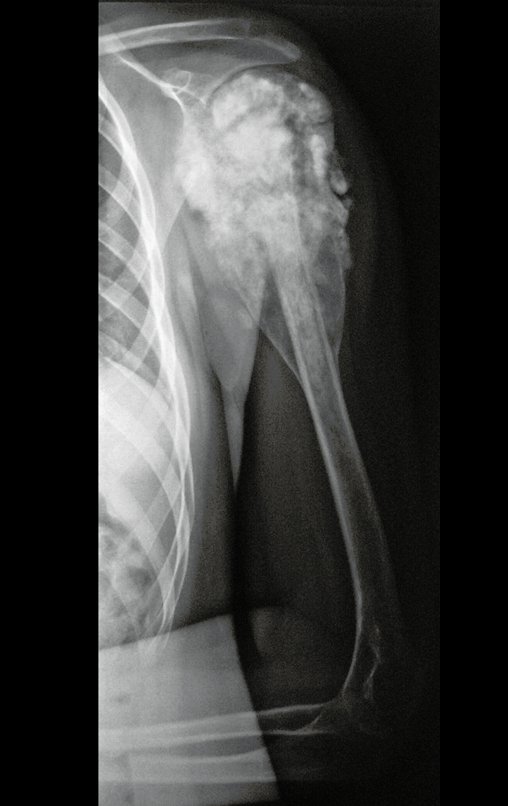
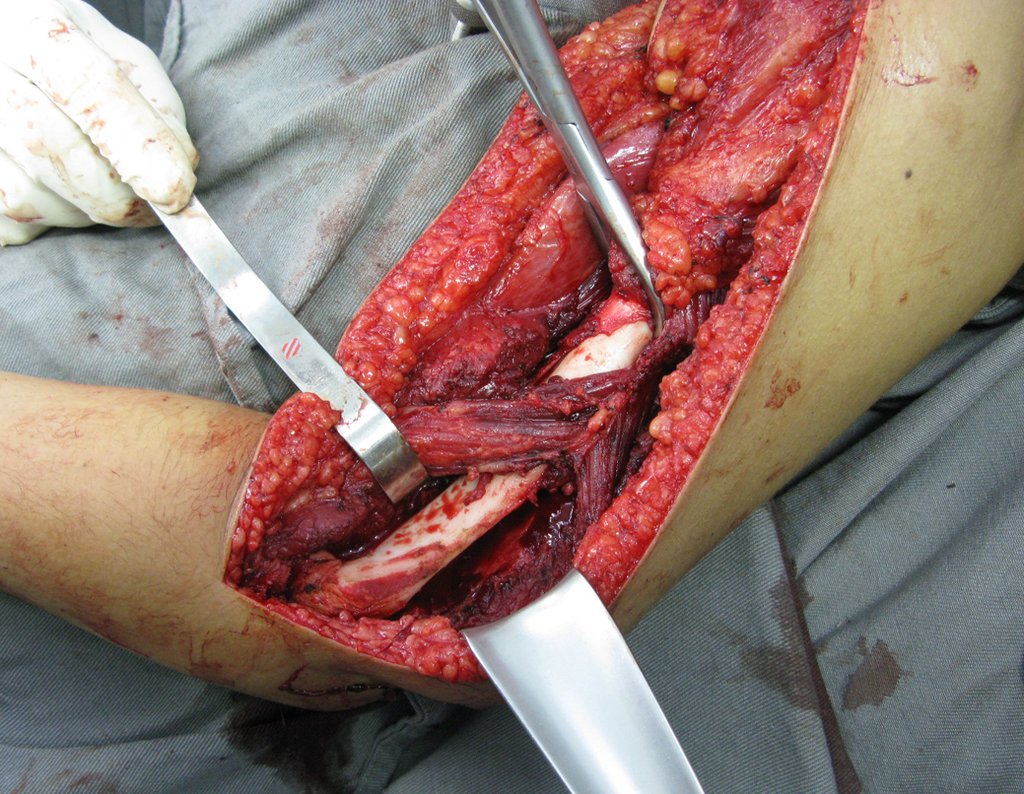
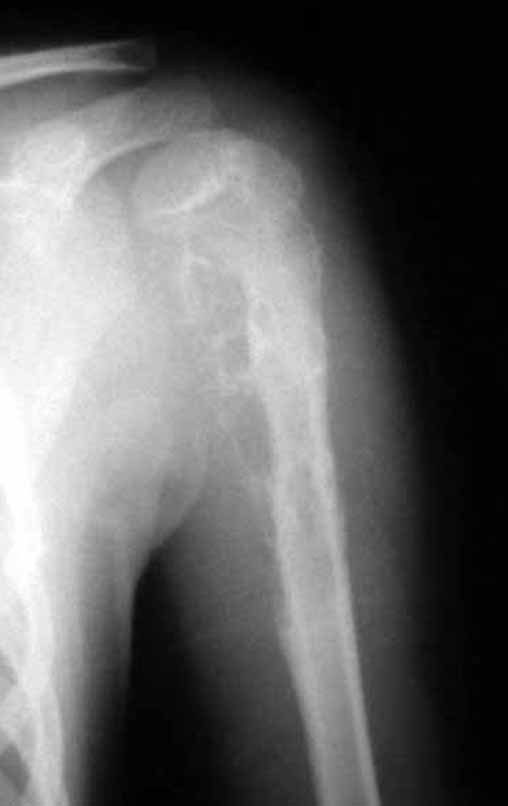
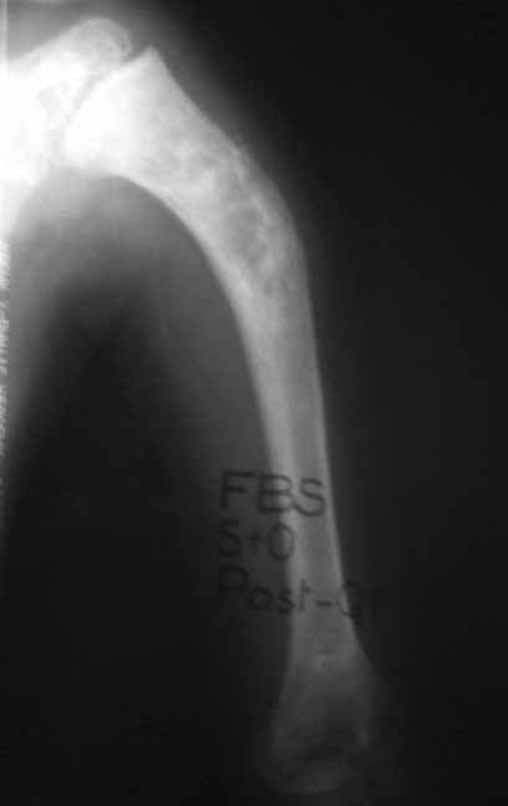
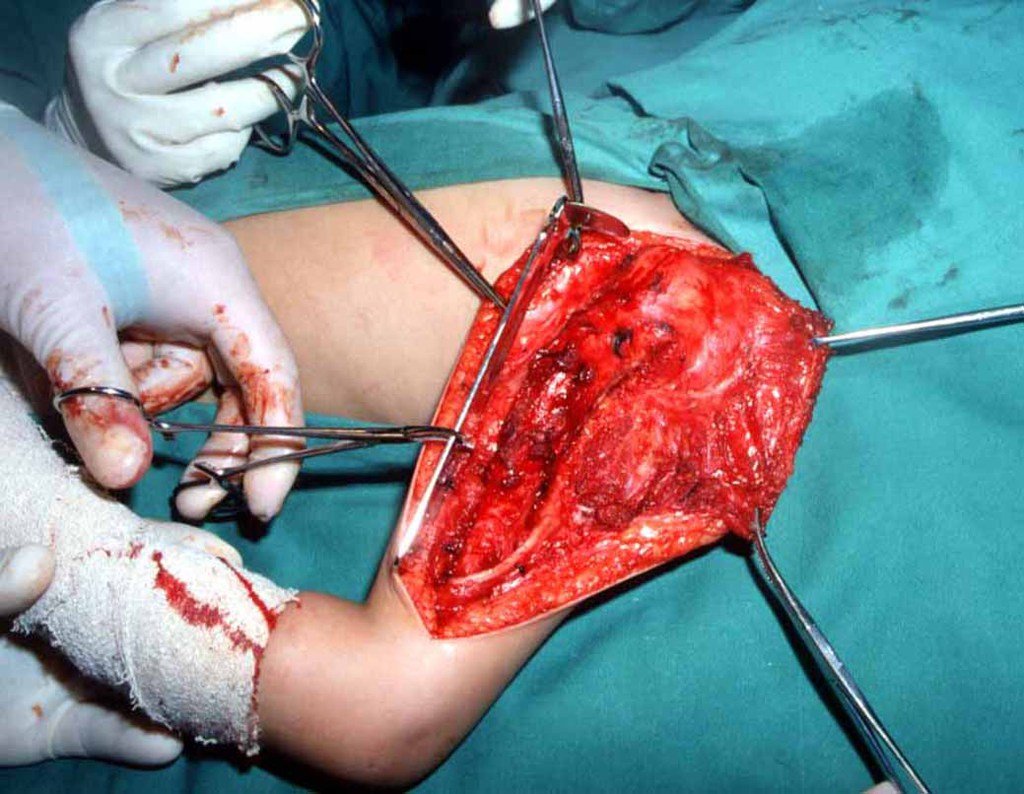
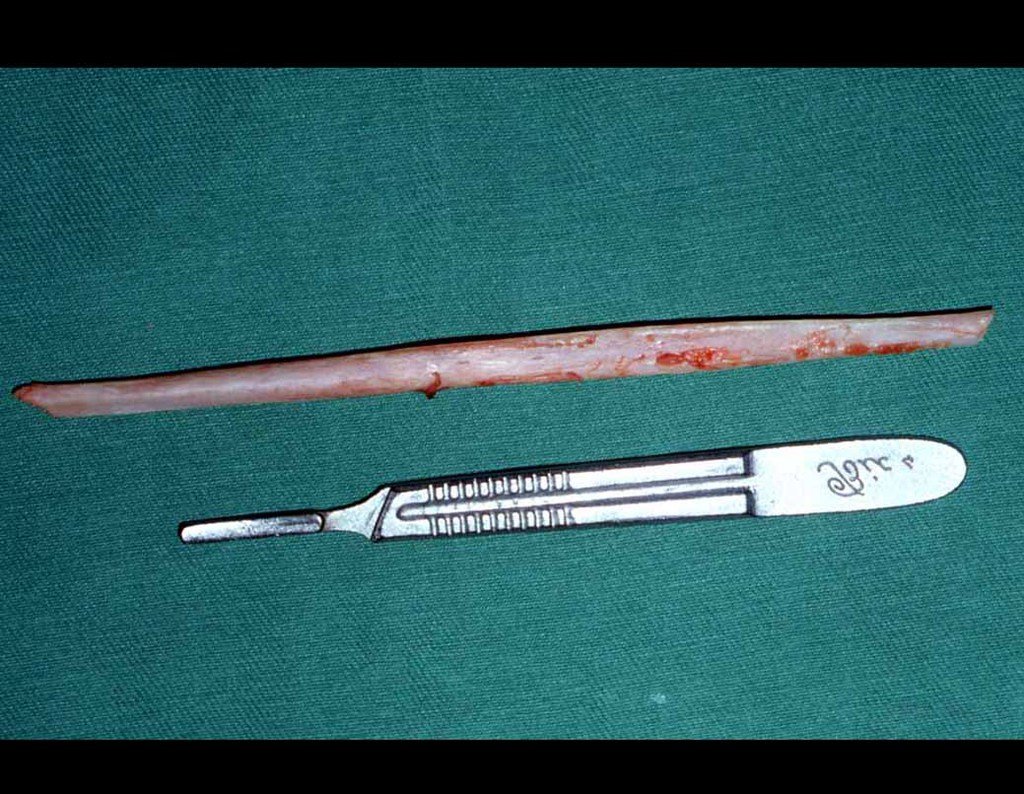
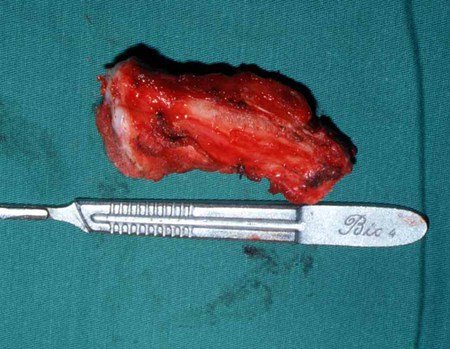
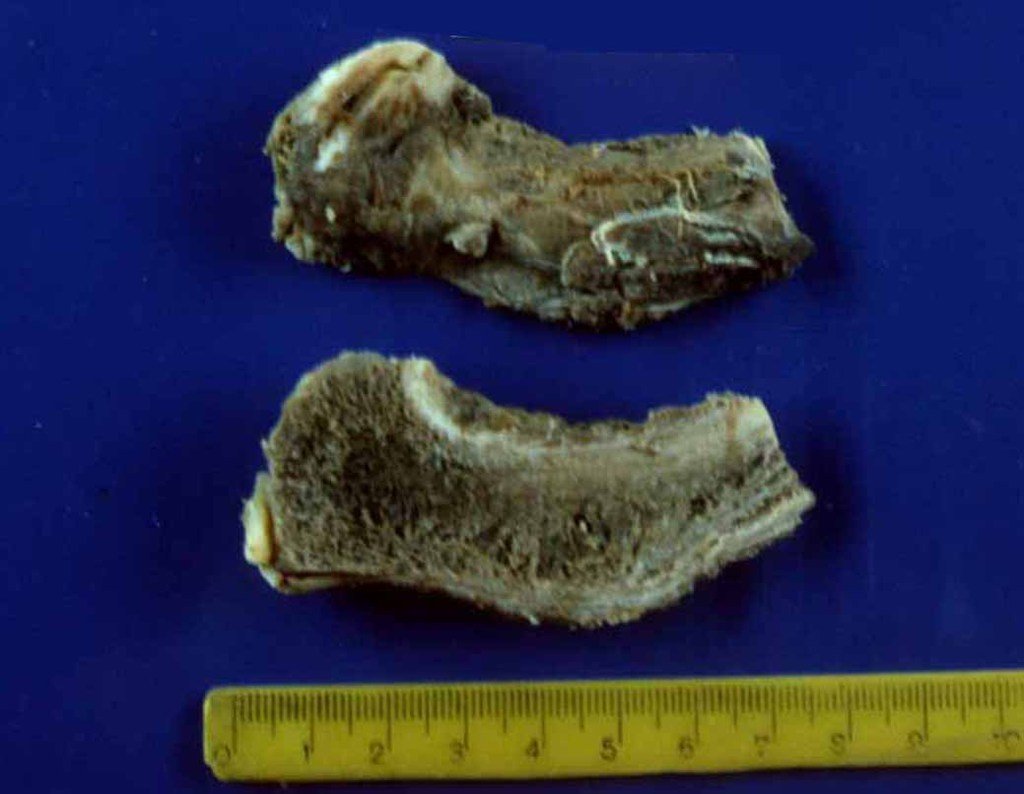
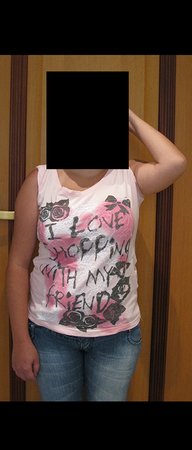O sarcoma de Ewing é tumor maligno composto por células indiferenciadas pequenas e redondas.
Sarcoma de Ewing
Apresenta incidência máxima na primeira e segunda décadas de vida, sendo raro após a terceira, com uma preponderância de 2:1 do sexo masculino sobre o feminino.
Há muita controvérsia quanto a célula de origem do sarcoma de Ewing, no entanto estudos mais recentes defendem a origem neuroectodérmica.
O tumor de Ewing acomete principalmente a região metafisária dos ossos tubulares longos e a pelve.
Macroscópicamente, a lesão óssea é caracterizada por um cinza esbranquiçado, de consistência mole. Este tumor ultrapassa precocemente a cortical, causando a elevação do periósteo com formação subperiosteal de osso novo, característico nessa doença, fornecendo uma imagem radiografica com aspecto de “casca de cebola”.
Histologicamente é composto por numerosas células uniformemente distribuídas, pequenas e redondas, semelhantes a linfócitos, porém de maior tamanho. A técnica de impregnação argêntica no estudo histológico revela escassez de fibras de reticulina, sendo estas encontradas apenas ao redor de vasos, ao contrário dos linfomas nos quais se observa rica trama de reticulina. No citoplasma das células do sarcoma de Ewing identifica-se abundante quantidade de glicogênio pela coloração de PAS.
As manifestações clínicas do sarcoma de Ewing são de dor, tumefação, hipersensibilidade da parte afetada, circulação colateral, temperatura local elevada e aumento na velocidade de hemossedimentação, podendo mascarar-se como quadro de osteomielite. No início é possível que não haja alterações radiográficas ou que as alterações sejam pequenas e mal definidas. Com a progressão da doença, o tumor induz formação de grandes áreas de lise óssea a corroerem as trabéculas esponjosas e, a seguir, a cortical de dentro para fora, dando à radiografia um aspecto de “roído de traça” . Muito precocemente apresenta massa tumoral extra cortical, em grande volume, contendo mais tumor fora do osso do que dentro dele.
O diagnóstico diferencial é feito com o osteossarcoma, o granuloma eosinófilo, o rabdomiossarcoma e a osteomielite
O tratamento atual consiste em poliquimioterapia pré-operatória, cirurgia de ressecção da lesão seguida de poliquimioterapia pós-operatória. No tratamento cirúrgico, após a ressecção da lesão, pode-se realizar a reconstrução do segmento com endopróteses, enxerto ósseo de banco e enxerto autólogo.
A avaliação da resposta à quimioterapia pré-operatória orienta o tratamento, tem valor prognóstico e é feita com o estudo do material ressecado na cirurgia. Essa avaliação é classificada em graus, a saber:
I – até 50% de necrose tumoral
II – entre 50% e 90% de necrose tumoral
III – acima de 90% de necrose tumoral
IV – ausência de neoplasia histologicamente viável
Atualmente com as excelentes respostas ao tratamento quimioterápico e às expectativas de “cura” da doença (pacientes com mais de quinze anos de tratamento, vivos e clinicamente bem), procura-se sempre que possível realizar tratamento cirúrgico com soluções biológicas, pois são definitivas e evitam as complicações decorrentes das endopróteses ou enxertos de banco, cuja durabilidade é limitada.
Autor : Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel:+55 11 99863-5577 Email: drpprb@gmail.com
Para melhor compreensão, sugerimos que leia primeiramente os capítulos:
https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/
Considerações sobre Biópsia
1. Somente após a avaliação clínica, com a realização da anamnese e exame clínico cuidadosos, que nos permitirão levantar as hipóteses de diagnósticos, é que deveremos solicitar os exames complementares.
Com a análise dos exames complementares deveremos verificar:
A- Se nossas hipóteses são compatíveis com os exames e continuam se enquadrando como possíveis diagnósticos;
B- Se apareceu nova hipótese, que não havíamos pensado, e teremos que refazer o nosso raciocínio clínico.
C- Se os exames estão corretos, bem-feitos, imagens centradas na lesão, com boa qualidade ou teremos que as repetir.
2. As hipóteses de diagnóstico devem ser feitas primeiramente com a clínica, exames laboratoriais e a imagem.
3. A patologia deve ser colocada como uma “ferramenta” para confirmar ou não a suspeita diagnóstica.
Se o exame anatomopatológico revelar um diagnóstico que não estava em nossa lista, deveremos reanalisar o caso, refazer nosso raciocínio. Caso não haja correlação clínica, radiológica e anatomopatológica algo pode estar errado e precisaremos rever conjuntamente, em equipe multidisciplinar, para determinarmos a melhor conduta. Nova biópsia?
4. Para o raciocínio do diagnóstico é preciso primeiramente enquadrar a afecção que estamos analisando dentro dos cinco capítulos da patologia, figuras 1 e 2.
18. Biópsia – conceito – tipos – indicações – planejamento
5. Se concluirmos que nosso paciente apresenta uma neoplasia, precisamos realizar o exercício de raciocínio já descrito nos capítulos de Introdução ao Estudo dos Tumores e Diagnóstico dos Tumores (Links: https://oncocirurgia.com.br/introducao-ao-estudo-dos-tumores-osseos/ e https://oncocirurgia.com.br/diagnostico-dos-tumores/ ).
Após estas etapas é que podemos pensar na biópsia, como “ferramenta” para o diagnóstico definitivo.
Antes de abordarmos o tema “biópsia” vamos analisar alguns casos.
Paciente A: figuras 3 e 4.
Há trinta dias, solicitaram a realização de biópsia de uma lesão da parede abdominal, em paciente internado para investigação.
O médico do paciente encontrou-me na sala de radiologia, analisando a tomografia.
Seguindo o “como eu penso” sobre as lesões perguntei-me: – que estruturas formam a parede abdominal? a. pele (carcinoma espinocelular, basocelular, melanoma); b. subcutâneo (lipoma, lipossarcoma); c. fáscia muscular (fibroma desmóide); d. músculo estriado (fibroma, fibrossarcoma, fibroma desmóide, rabdomiossarcoma); e. vaso (hemangioma, leiomiossarcoma); f. peritônio e cavidade abdominal (já não é minha jurisdição).
Pareceu-me uma extensa lesão e sugeri que procurasse um cirurgião da área, pois eu não saberia conduzir, caso fosse neoplasia maligna. O ideal é que a biópsia seja realizada por aquele que vai operar o paciente.
Relatou-me que o paciente estava ictérico, havia realizados ultrassom e vários exames laboratoriais, insistindo-me a realizar a biópsia. Perguntei-lhe alguns dados e como não sabia informar-me sugeri que passássemos visita no leito. Poderíamos extrair a história clínica e examinar o paciente.
O paciente referiu ser asmático, relatou que o sintoma começou abruptamente após acesso de tosse havia onze dias, em mudança repentina de tempo, com frio e garoa. Apresentou fortíssima dor na parede anterior do abdome, onde apareceu uma “bola”. O abaulamento e a dor estavam diminuindo e a parede lateral tinha endurecido.
Saindo do quarto sugeri que não fizéssemos biópsia, que desse alta para o paciente, que a icterícia com bilirrubina elevada era resultado de um grande hematoma que havia infiltrado a parede lateral, devido à ruptura espontânea do reto anterior do abdome. Esta lesão já estava em reparação e a biópsia apenas mostraria o processo inflamatório cicatricial (com risco de vir miosite proliferativa).
Ainda não convencido, perguntou-me se eu já tinha visto caso de ruptura espontânea do músculo reto abdominal. Respondi não, mas era o que o bom senso dizia. Descendo pela escada encontramos um cirurgião geral e perguntei-lhe sobre o assunto. Este esclareceu que era comum em paciente com bronquite crônica que tomavam corticoide, como era o caso do nosso paciente. A história clínica fez o diagnóstico.
Pacientes B: Figura 5.
No ambulatório a residente pergunta:
– “Por que via de acesso devemos realizar a biópsia?”.
Vejo a imagem e pergunto-lhe: – Qual a idade da paciente?
– “Hum … Dona Maria, quantos anos a senhora tem?”
Reflito em silêncio, avaliando o desconhecimento do aprendiz. A paciente responde 67 anos DOUTOR!
… Sessenta e sete anos, lesões múltiplas, metástase? Mieloma múltiplo? Tumor marrom do hiperparatireoidismo? – Há quanto tempo ela tem os sintomas?
– “Hum … Dona Maria, há quanto tempo a senhora tem esse problema?”
No prontuário vejo anotado sintomas de dor na tuberosidade isquiática, realizado dosagem de Ca++, P++, FA, Na+, K+, eletroforese de proteínas, hemograma, VHS, glicemia, ureia, creatinina, ultrassom, radiografias, …, …
Ao examinar a paciente observo que o “tumor” é anterior, na região inguinal, e não posterior, como estava anotado no prontuário, “tuberosidade isquiática”. A paciente não havia sido examinada!!! Apresentava hérnia ínguino-crural. As imagens da radiografia da pelve representam gases do intestino. A “biópsia” resultaria em perfuração intestinal. O exame físico fez o diagnóstico.
Paciente C: Figura 6.
Passando pelo pronto socorro a plantonista pergunta:
– “Doutor, que tumor o senhor acha que este paciente tem? Podemos agendar a biópsia?”.
Nenhum dado de história o residente sabia relatar e havia feito apenas a radiografia de frente!!! Perguntado, o paciente informa que os sintomas inflamatórios começaram havia seis meses, com dor calor e saída de secreção purulenta. Quando estava aberto, secretando, os sintomas melhoravam. Quando fechava a fístula começava a inchar, doer e tinha febre.
Com dificuldade, pois o paciente muitas vezes sonega informação, soubemos que ele tinha sido ferido na coxa havia dois anos, ao pular a grade de proteção de uma casa, que sangrou bastante, mas não procurou atendimento (história clínica). Pedimos uma radiografia de perfil que comprovou tratar-se de corpo estranho. A ponta da lança da grade estava envolta por reação periosteal sólida, dando a falsa impressão de tumor esclerótico. O exame de imagem adequado confirmou o diagnóstico.
Após estas importantes considerações, vamos estudar o controverso tema da biópsia.
PRECISAMOS:
1- Definir as hipóteses de possíveis diagnósticos, para o nosso caso, primeiramente com a história clínica e exame físico;
2- Realizar os exames laboratoriais e de imagens, para corroborar ou não nossas hipóteses, nosso raciocínio e
3- Somente após estas etapas, poderemos realizar a biópsia, para a patologia “reconhecer a firma” do diagnóstico, previamente pensado com a nossa anamnese, exame físico, laboratoriais e de imagem.
“A anatomia patológica não é caminho curto para o diagnóstico. Devemos correlacioná-la sempre com a clínica, exames laboratoriais e de imagem”.
Quanto à biópsia, podemos subdividir as lesões músculo esqueléticas em três grupos:
- Casos em que o diagnóstico CLÍNICO – RADIOLÓGICO (imagem) é suficiente para o diagnóstico e tratamento, não sendo indicada a biópsia.
- Casos que podem prescindir deste procedimento por dificuldade de diagnóstico histológico, e que pelas características de agressividade clínica e radiológica não se deve alterar a conduta cirúrgica necessária.
- Casos que necessitam da confirmação patológica para tratamento quimioterápico prévio à cirurgia
Vamos discorrer sobre os três grupos, analisando alguns exemplos, figuras a seguir.
GRUPOS 1 e 2: A biópsia não é necessária ou não altera a conduta.
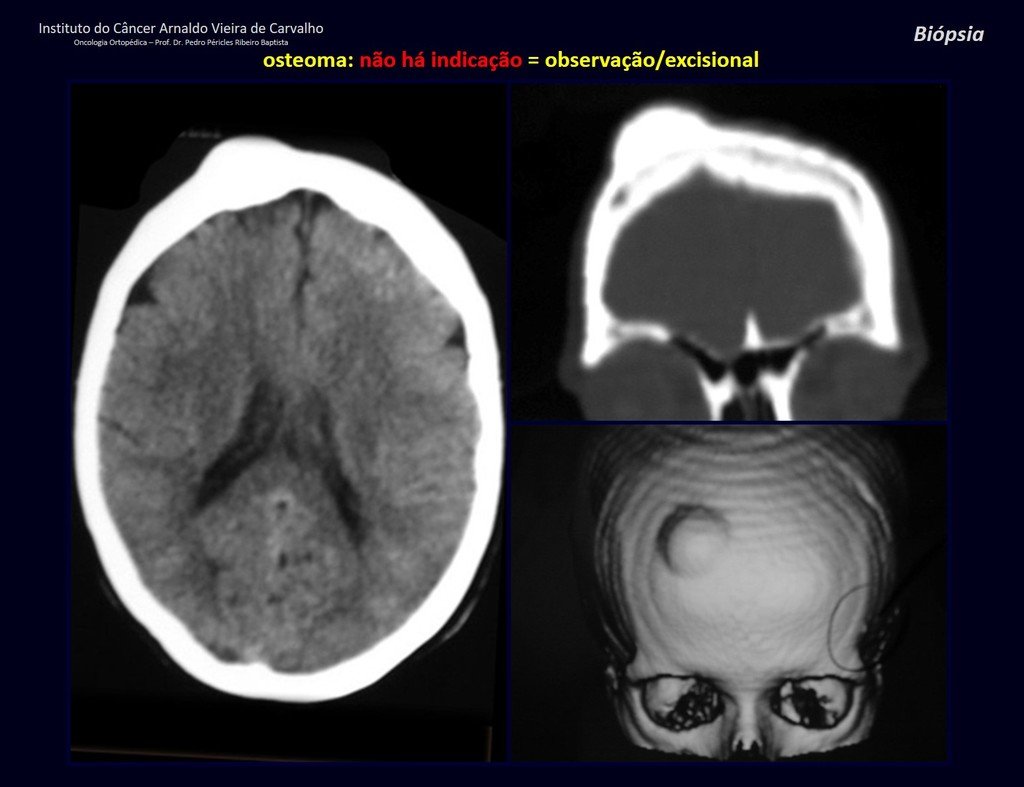
1a. OSTEOMA, figuras 13 a 18.
IDENTIDADE: Lesão neoplásica benigna, bem delimitada, caracterizada por tumor homogêneo, esclerótico e denso, tecido ósseo maduro. É osso dentro de osso.
Estas lesões são bem delimitadas, homogêneas, sem sintomas. São diagnosticadas por achados ocasionais de exames de imagem ou por apresentarem alterações estéticas. Eventualmente podem ser sintomáticos, como num caso que obstruiu a fossa nasal dificultando a respiração. O diagnóstico é clínico e radiológico, não necessitam de biópsia. O tratamento restringe-se à observação e acompanhamento. São raros e eventualmente operados.
1b. OSTEOMA OSTEÓIDE, figuras 19 a 26.
IDENTIDADE: Lesão neoplásica benigna, caracterizada por um tumor circunscrito, com até aproximadamente um centímetro de diâmetro, que apresenta um nicho osteóide central, circundado por halo de esclerose e localizado na cortical dos ossos longos, parte mais compacta.
A região do colo femoral é revestida por um periósteo delgado que não apresenta reação periosteal. Isto dificulta a localização da lesão na cirurgia.
A realização de um orifício na cortical óssea, perto da lesão, guiado por radioscopia, facilitará a operação.
Após esta marcação, fazemos uma tomografia para mensurar a distância do orifício ao centro da lesão, localizando-o. Veja a técnica completa em: http://técnica de ressecção de osteoma osteóide
O osteoma osteóide é uma lesão da cortical óssea. Na coluna vertebral ocorre no pedículo, que é a parte mais compacta, mais dura, assemelhando-se à cortical.
Apresenta um nicho central com halo de esclerose ao redor e não ultrapassa um centímetro.
Não existe “osteoma osteóide gigante”, maior que 1,5 cm, pois nesta situação há erosão da cortical, não há delimitação pelo halo de esclerose e, apesar de poder apresentar histologia semelhante, estamos diante de um osteoblastoma, que é uma lesão benigna, porém agressiva localmente. O osteoblastoma pode ou não estar associado a um cisto ósseo aneurismático e ainda fazer diagnóstico diferencial com osteossarcoma teleangiectásico. Leia também: http://osteoma osteóide
1c. OSTEOCONDROMA, figuras 27 a 32.
IDENTIDADE: É uma exostose em que o osso esponjoso central continua-se com a medular do osso afetado e a camada densa periférica, cortical do tumor, continua-se com a cortical do osso comprometido. Apresenta-se com base alargada, séssil, ou estreita, pediculada. Pode ser único ou múltiplo (osteocondromatose hereditária).
Os osteocondromas são de tratamento cirúrgico quando alteram a estética ou a função, deslocando e comprimindo estruturas vásculo-nervosas, limitando os movimentos ou gerando deformidades angulares. É a lesão óssea benigna mais frequente.
Geralmente crescem enquanto o paciente encontra-se em fase de crescimento. Quando um osteocondroma aumenta de tamanho, depois de terminada a maturidade esquelética pode significar bursite pós-traumática ou malignização para condrossarcoma e deve ser tratado como tal, ressecando-se com margem oncológica.
O osteocondroma solitário apresenta 1% de taxa de malignização. A osteocondromatose múltipla, pode chegar a 10%.
O diagnóstico do osteocondroma é clínico e radiológico e não necessita de biópsia para o seu tratamento.
Leia: http://osteocondroma
1d. CONDROMA, figuras 33 a 50.
IDENTIDADE: Tumor benigno, indolor, formador de cartilagem com focos de calcificação nos ossos curtos das mãos e pés, diagnosticado por acaso ou devido à deformidade ou fratura. Pode ser solitário ou múltiplo (encondromatose, síndrome de Maffucci, doença de Ollier).
Nos dedos das mãos e dos pés, as lesões cartilaginosas geralmente têm comportamento benigno.
A eventual evolução indesejada para um condrossarcoma, de uma cirurgia de curetagem nestas localizações, não compromete a possibilidade de cura, pois a ressecção completa do dedo, que é o tratamento do condrossarcoma, continuaria sendo possível.
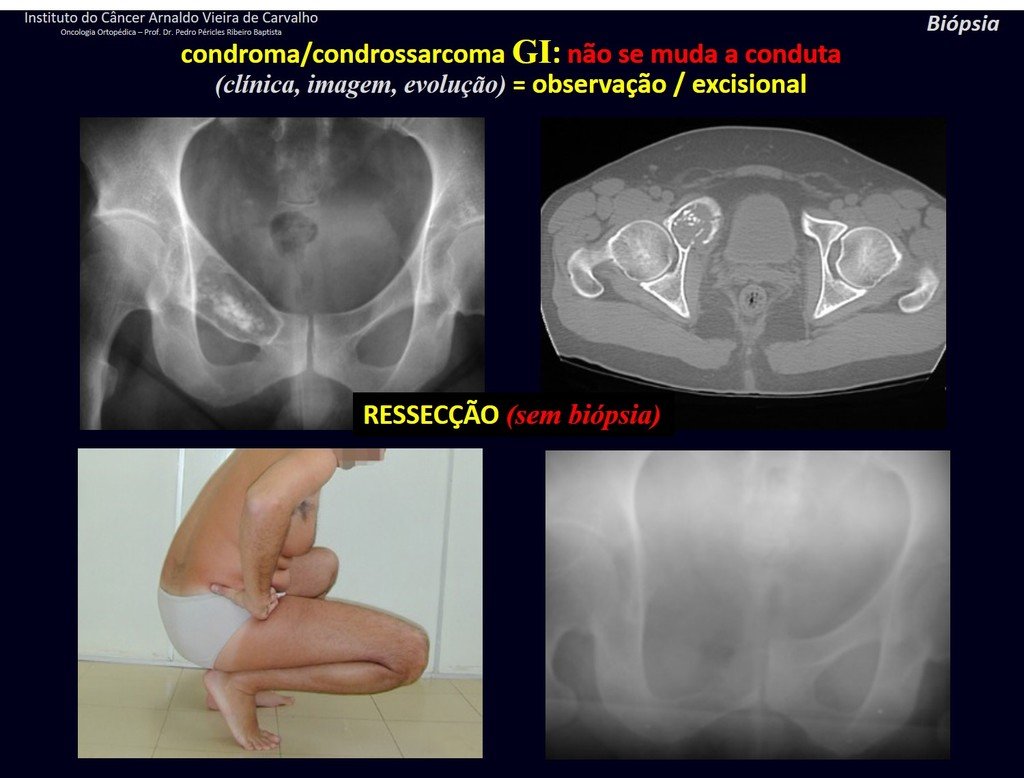
CONTROVÉRSIA: CONDROMA OU CONDROSSARCOMA GRAU I?
O condroma ocorre eventualmente na metáfise dos ossos longos (fêmur distal, úmero e tíbia proximal) e raízes dos membros (ombro, pelve). Nestes casos, pode confundir-se com infarto ósseo ou condrossarcoma grau I.
Nos achados ocasionais, como o diagnóstico anatomopatológico entre condroma e condrossarcoma grau I é controverso, é preferível não realizar a biópsia e acompanhar clínica e radiograficamente se há evolução.
O condrossarcoma grau I é de evolução lenta, o que permite este acompanhamento, possibilitando a observação para o diagnóstico seguro da sua atividade ou não.
Repete-se os exames com um, três e seis meses, e depois anualmente. O tumor deve ser tratado cirurgicamente como condrossarcoma em qualquer momento, se a comparação entre as imagens revelar alteração da lesão.
Caso a lesão continue inalterada, a melhor conduta é continuar acompanhando. Alguns pacientes questionam até quando? A resposta é: – Sempre. A reavaliação deverá continuar de qualquer forma, quer o paciente seja operado ou não.
Tratar uma lesão, assintomática, achado casual, sem mudança de imagem com cirurgia menor é “overtreatment”, o qual também precisará de acompanhamento ou pior, caso o anatomopatológico revelar histologia maligna.
Exemplificando esta conduta, vamos analisar o seguinte caso, acompanhado há 14 anos, figuras 39 a 42.
CONDROMA ou CONDROSSARCOMA? Nestes casos o bom senso deve prevalecer, ele nos adverte que o papel aceita qualquer escrita.
Devemos nos basear no comportamento clínico da lesão. Houve ou não alteração? De uma eventual biópsia, que se optar por realizar, só poderemos acrescentar que se trata ou não de uma “lesão cartilaginosa”. Não podemos mudar a nossa conduta: OBSERVAR OU OPERAR COMO CONDROSSARCOMA. Por segurança, se optarmos por operar, devemos tratar cirurgicamente como condrossarcoma, que é a nossa única “ferramenta”, pois não respondem à quimioterapia nem à radioterapia.
Continuando, analisemos as figuras 43 a 50.



A mensagem que pretendemos deixar é:
¨O médico pode realizar a biópsia, pois é uma conduta acadêmica, que lhe dá mais respaldo quanto a ser uma lesão cartilaginosa. Mas não deve operar com técnica de curetagem, como condroma, pois os condromas latentes dos ossos longos, achados casuais não requerem tratamento cirúrgico e sim observação. A biópsia atrapalha esta observação pois não saberemos se a dor e alteração da imagem, que eventualmente ocorrer posteriormente à biópsia, seria devido a agressão da biópsia ou se é um condrossarcoma manifestando-se. Concluindo, se o médico optar por intervir, deve operar como condrossarcoma. Lembramos ainda que a cirurgia, realizada por qualquer técnica, não eliminará a necessidade de observação e acompanhamento¨.
1e. CONDROBLASTOMA, figuras 51 a 54.
IDENTIDADE: Lesão neoplásica epifisária benigna, do esqueleto em crescimento, (1a e 2a décadas), caracterizada por rarefação óssea, erosão da cartilagem articular com insuflação, células cartilaginosas (condroblastos), células gigantes e focos de calcificação.
1f. CISTO ÓSSEO SIMPLES – C.O.S. , figuras 55 a 58.
IDENTIDADE: Lesão pseudoneoplásica, unicameral, circundada por membrana, bem delimitada, preenchida com líquido seroso, de localização metafisária central, que não ultrapassa a sua largura e ocorre em crianças e adolescentes.
Leia: http://cisto ósseo simples
1g. CISTO ÓSSEO JUSTAARTICULAR – GANGLION, figuras 59 a 62.
IDENTIDADE: Lesão pseudoneoplásica, de localização epifisária, unicameral, circundada por membrana sinovial, bem delimitada e preenchida com líquido seroso, que se comunica com a articulação adjacente.
Estas lesões não requerem a realização de biópsia para o tratamento.
1h. DEFEITO FIBROSO CORTICAL / FIBROMA NÃO OSSIFICANTE, figuras 63 e 64.
IDENTIDADE: Lesão pseudoneoplásica na cortical óssea de limites precisos, assintomática. Achado ocasional.
1i. DISPLASIA FIBROSA DA TÍBIA / OSTEOFIBRODISPLASIA, figuras 65 a 70.
IDENTIDADE: Lesão pseudoneoplásica na diáfise da tíbia com rarefação óssea de densidade intermediária, como se o osso tivesse sido “apagado”, aspecto de vidro fosco. Pode ocorrer em mais de uma localização. Sua evolução é variável podendo causar deformidade, desdiferenciar-se ou ter um crescimento harmônico, estabilizando-se na maturidade esquelética.
1J. MIOSITE OSSIFICANTE, figuras 71 e 72.
IDENTIDADE: Lesão localizada próxima de um osso e em tecidos moles, relacionada a traumatismo pregresso, cuja ossificação inicia-se na periferia.
1k. TUMOR DE TECIDOS MOLES – ALGUNS, figuras 73 a 78.
IDENTIDADE: Lesões delimitadas, homogêneas, com imagens típicas, sem captação de contraste ou com captação apenas na periferia, podem ser operadas sem biópsia prévia, quando a conduta cirúrgica não seria diferente, mesmo em tratando-se de neoplasia maligna.
Os tumores malignos de tecidos moles teriam o mesmo procedimento de ressecção cirúrgica, com as margens exíguas apresentadas no caso acima e seriam complementados com radioterapia local. Os sarcomas de tecidos moles, até o presente momento, não respondem a quimioterapia nem apresentam melhora no índice de sobrevivência do paciente.
Uma eventual biópsia poderia provocar lesão nervosa e não mudaria a conduta.
A biópsia pode ser realizada, é acadêmica, complementa os estudos do caso, mas a conduta cirúrgica de ressecção deve prevalecer, mesmo em se tratando de neoplasia maligna. Os sarcomas de tecidos moles, até o presente momento, não se beneficiam com tratamento neoadjuvante e a cirurgia ablativa não altera a sobrevivência.
GRUPOS 3: A biópsia é necessária para o tratamento (cirurgia; com/ sem neoadjuvancia)
Precisamos ressaltar que a biópsia deve ser executada/acompanhada pelo cirurgião que vai realizar a cirurgia. Sua presença é essencial para que esta seja realizada de acordo com o planejamento da cirurgia.
Não se deve realizar incisões transversas, nem incisões extensas onde não há musculatura para posterior cobertura, como na perna por exemplo. A sutura não deve ter pontos distantes da incisão, pois isto exigirá uma ressecção mais larga de tecido e muito menos realizar-se mais de uma incisão, figuras 79 (quadros A, B, C e D) e 80.
Veja o caso completo da figura 80 em: http://tgc-prótese intraepifisária
A seguir, exemplificamos dois casos de biópsias realizadas corretamente, figuras 83 a 86.
*Veja o caso completo da figura 83 e 84 em: http://transplante de cartilagem de crescimento
*Veja o caso completo da figura 85 e 86 em: http://prótese parcial rotatória
PLANEJAMENTO E EXECUÇÃO DAS BIÓPSIAS: CONSIDERAÇÕES – COMO EXECUTAR
Considerações do Caso 1: Vamos descrever como procedemos nesta paciente feminina, 40 anos de idade, dor na crista ilíaca póstero superior a direita, havia seis meses, figuras 87 a 116.
Na análise da ressonância estudamos o comprometimento da lesão, planejamos o acesso cirúrgico e a tática de ressecção com margem, para então escolhermos o trajeto mais adequado e seguro para a nossa biópsia, figuras 91 e 92.

Assim a ressecção planejada é de se acessar por incisão seguindo pela crista ilíaca, dissecando externamente pelo plano gorduroso e internamente descolando o peritônio. Pretendíamos colocar a paciente em decúbito dorsal, mas enquanto paramentava a paciente foi anestesiada e posicionada em decúbito prono, o que dificultava o procedimento, a nosso ver, figuras 93 e 94.
O operador de Rx argumentou que aquela posição era a melhor e que conseguiríamos facilmente o material para o estudo histológico e … fez um X por onde iria obter a amostra! Figuras 95 e 96.
Expliquei-lhe que não deveríamos mudar a direção da incisão cirúrgica planejado, pois isto dificultaria o acesso interno à pelve. Orientamos para puncionar no ponto lateral da crista, apesar da dificuldade de angulação da agulha, devido ao decúbito prono. Este procedimento é descrito como ¨biópsia de congelação¨, figuras 97 a 102.
Com a confirmação de tumor cartilaginoso, provável condrossarcoma GII, realizamos a ressecção parcial da pelve direita, conforme planejado, sem neoadjuvancia, figuras 103 a 116.
Video 1: Exposição da face interna da pelve e osteotomia delicada, realizada com brocas minimamente invasivas.
Considerações do Caso 2: Vamos agora discutir a biópsia neste paciente com onze anos de idade, com dor e tumor na coxa esquerda havia duas semanas. Provável osteossarcoma, figuras 115 a 118.
Vemos, com muita frequência, pacientes com cicatrizes de biópsia realizadas na região ântero-lateral da metáfise distal do fêmur. A seta vermelha aponta a fáscia lata, que na maioria das vezes é interrompida pelo trajeto da biópsia, realizada por profissionais que não vão operar o paciente, dificultado a cobertura da futura cirurgia e a função deste membro que precisará ser reconstruído.
A seta amarela indica o trajeto póstero-lateral, mais adequado para a biópsia e para a reconstrução, propiciando a melhor cobertura e função.
Para a realização da biópsia por este trajeto o posicionamento adequado do paciente é em decúbito prono, figuras 119 a 122.
O tratamento de tumores da extremidade distal do fêmur, como esta lesão, com este grau de comprometimento e localização, indicamos a biópsia conforme descrevemos e a realização de quimioterapia neoadjuvante de indução, ressecção com margem oncológica e reconstrução com prótese modular e quimioterapia adjuvante.
O paciente deste exemplo está fora de tratamento, com excelente função, podendo-se ver o caso completo no Link: http://osteossarcoma-discrepância de comprimento .
A realização de biópsia musculoesquelética, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes
“A realização de biópsias musculoesqueléticas, visando o diagnóstico e tratamento adequado das neoplasias, deve ser muito bem planejada e executada por profissionais experientes e com a participação do cirurgião que estará conduzindo o caso”.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
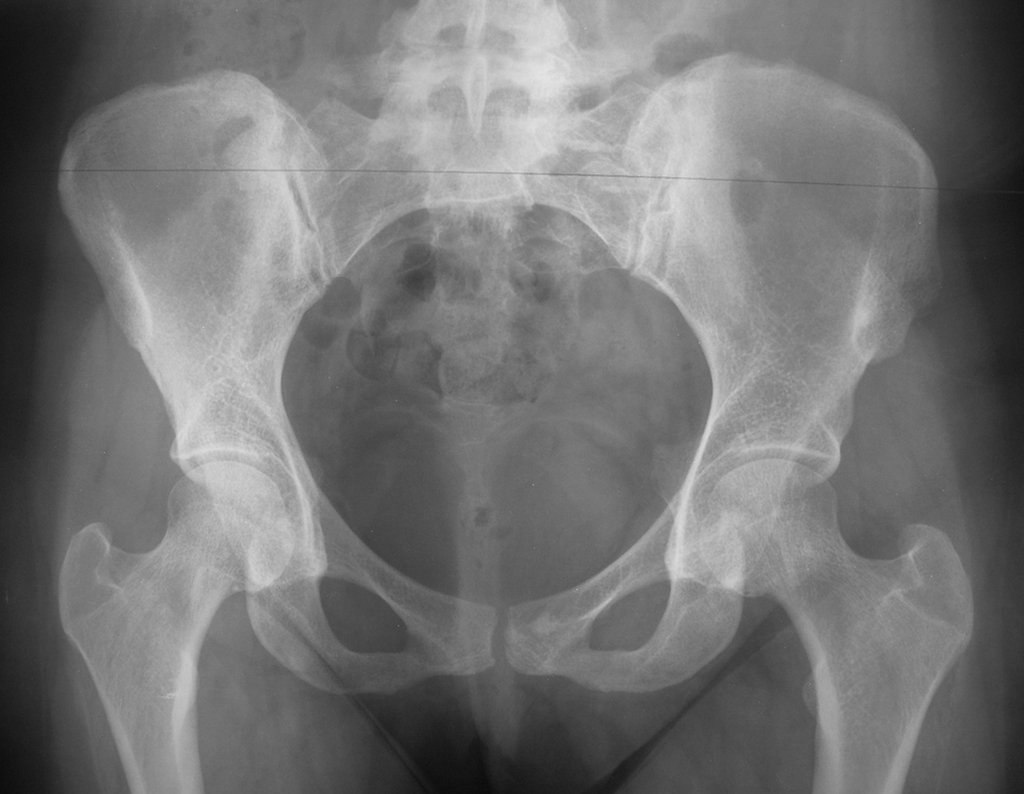
Técnica de Prótese Total do Úmero em Osteossarcoma. Paciente masculino, com 57 anos de idade, refere aparecimento de lombalgia, em final de outubro de 2014, com irradiação para o MIE. Devido a progressão dos sintomas, realizou uma ressonância da coluna que relatou presença de hérnia discal L5-S1. Iniciou fisioterapia e com a piora dos sintomas realizou uma tomografia em 18/02/2015, com relato de artrose facetaria L2-L3, L3-L4 e discopatia L5-S1 com protrusão ao canal medular e radiografias da bacia, figuras 1 e 2.
13. Técnica de Prótese Total do Úmero em Osteossarcoma.
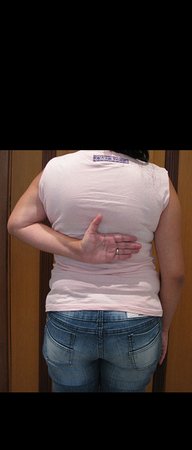
O aspecto clínico e a função do membro superior esquerdo, podem ser observados nas figuras 27 a 29.
O estudo das imagens e a análise do exame clínico, evidenciaram o comprometimento do músculo deltoide, porém com viabilidade de cirurgia conservadora, com margem, desde que se fizesse a ressecção completa do músculo envolvido e a substituição total do úmero por endoprótese modular de polietileno.
Apesar da necessidade do sacrifício funcional parcial do ombro, e da necessidade de reconstrução artroplástica, com tela de marlex para a cobertura proximal da prótese e estabilidade do ombro, a preservação do membro superior foi nossa indicação, visando oferecer um aspecto cosmético e funcional remanescente do membro satisfatório.
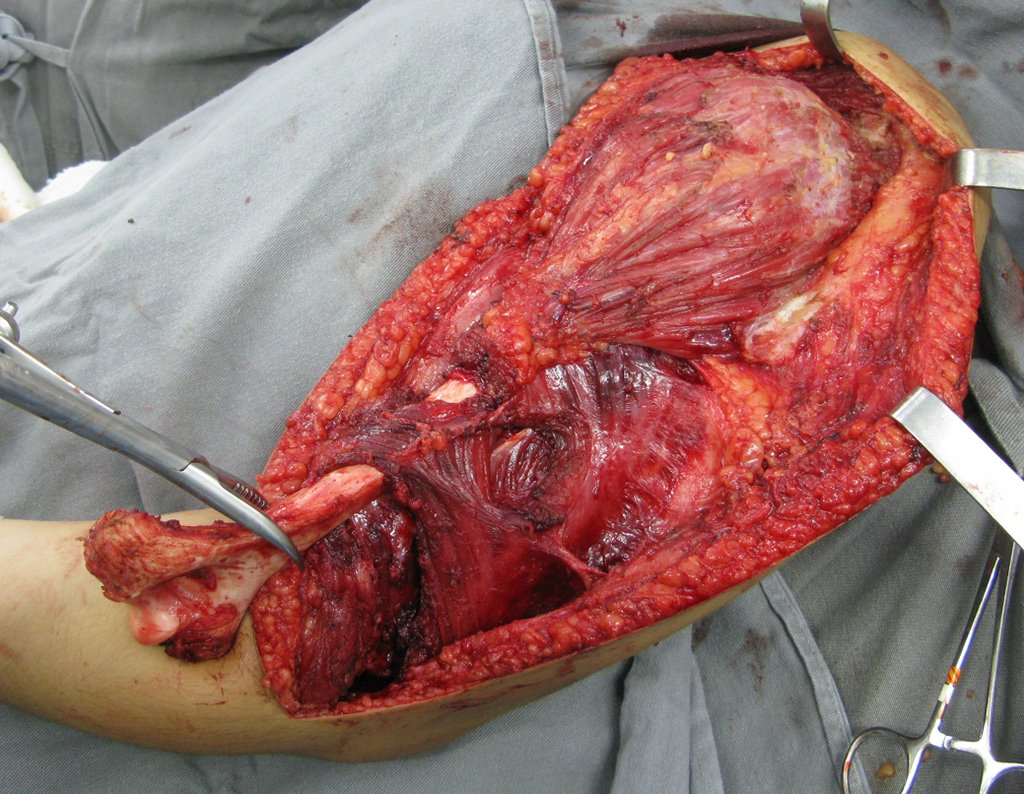
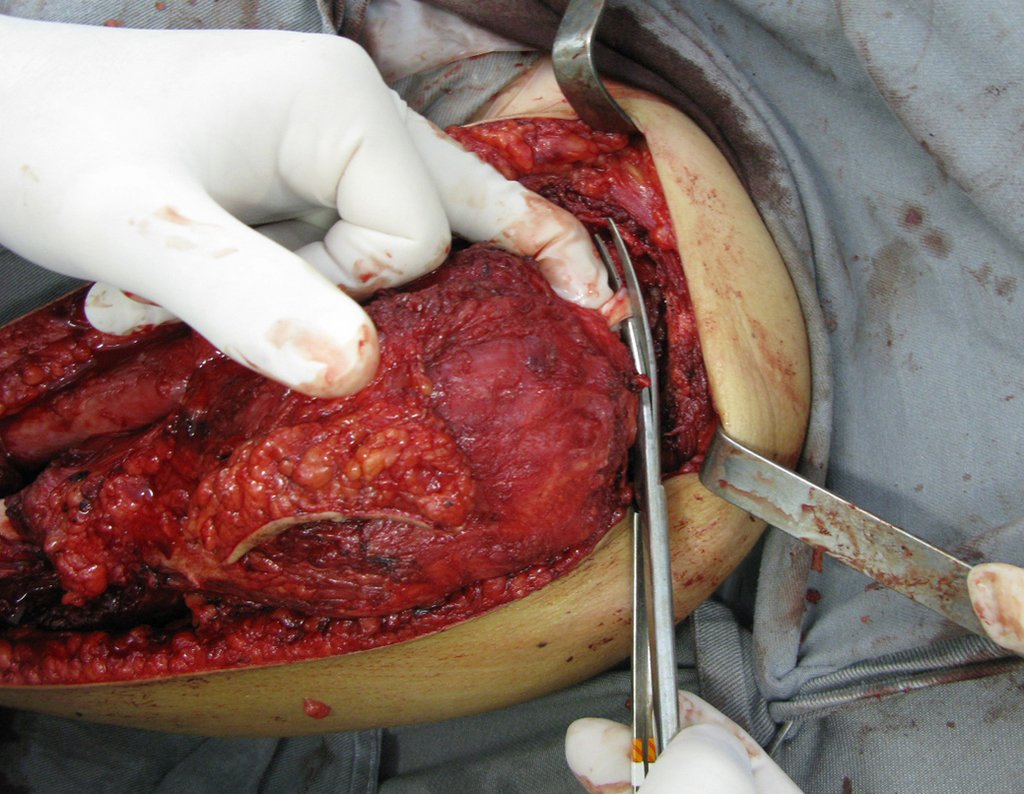
A cirurgia de resseção total do úmero esquerdo, incluindo todo o músculo deltoide e a reconstrução com endoprótese e tela de marlex podem ser estudadas nas figuras 31 a 75.
O vídeo 1 demonstra a reinserção do cabo longo do músculo bíceps braquial.
Vídeo 1: Sutura de tela de marlex ao redor da glenóide.
Como pudemos observar, todo o músculo deltoide e trajeto da biópsia, juntamente com a cápsula articular, foram ressecados. Restou apenas pele e tecido celular sub-cutâneo para a cobertura proximal da reconstrução umeral.
É preciso criar uma contenção ao redor da glenóide para estabilizar a prótese, evitando o seu deslocamento. Este mecanismo de contensão precisa permitir os movimentos rotacionais do úmero para propiciarmos uma função adequada.
Para obter este resultado vamos descrever em detalhes nossa técnica. O vídeo 2 ilustra a sutura de uma tela de marlex ao redor da glenóide, visando criar um ponto de fixação da porção proximal da prótese umeral que empregamos nesta reconstrução.
Vídeo 2: Fixação da tela de marlex na porção anterior da glenóide.
Vídeo 3: Cimentação e montagem da prótese de úmero proximal, definindo neste momento os 20 graus de rotação interna. Existe um respiro distal para a saída do excesso de cimento.
A prótese de polietileno é mais adequada por sua leveza em relação à uma totalmente metálica. O polietileno tem a elasticidade semelhante à do osso e permite que realizemos orifícios em pontos estratégicos para a reinserção de tendões e ligamentos, que eventualmente restaram mais encurtados, devido a necessidade de margem cirúrgica na ressecção.
Vídeo 4: Evidenciamos a boa fixação dos fios e da tela de marlex na região proximal da prótese total de úmero. Esta sutura é realizada com um pregueamento semelhante à saia escocesa, para permitir os movimentos de rotação.
Vídeo 5: Paciente no pós-operatório de uma semana, bom aspecto cosmético, iniciando fisioterapia.
Vídeo 6: Função do punho após 15 dias da cirurgia. Realiza por enquanto, apenas movimentos da mão e punho.
Vídeo 7: Função em agosto de 2015, após nove meses da cirurgia de ressecção total do úmero esquerdo, com exérese de todo o deltoide e reconstrução com endoprótese total de úmero com emprego de tela de marlex, para estabilização da articulação gleno protésica. Boa flexão do cotovelo, excelente função da mão e prono-supinação e boa rotação do úmero.
Vídeo 8: Paciente em fisioterapia, fazendo flexão do ombro com ajuda do membro contralateral, em 09-09-2015
Vídeo 9: Elevação do ombro com ajuda da bola e apoio na parede, em 09-09-2015
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com
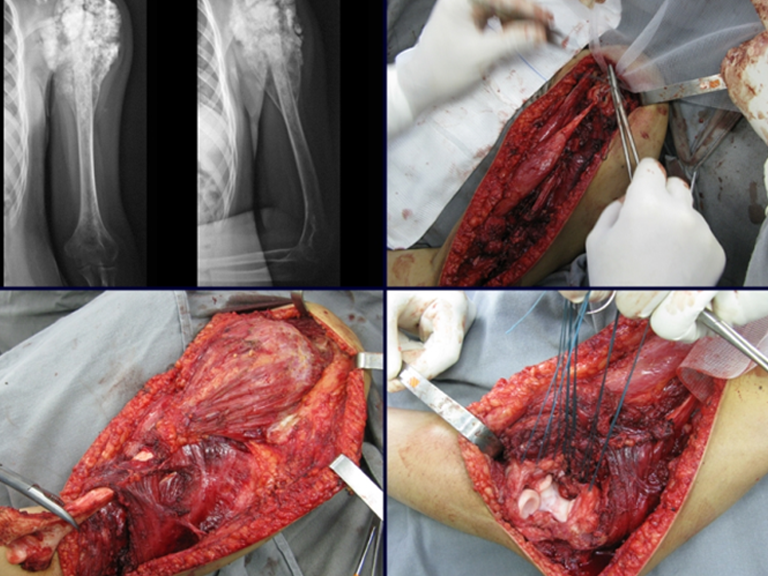
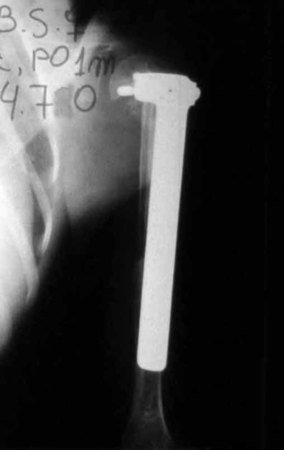
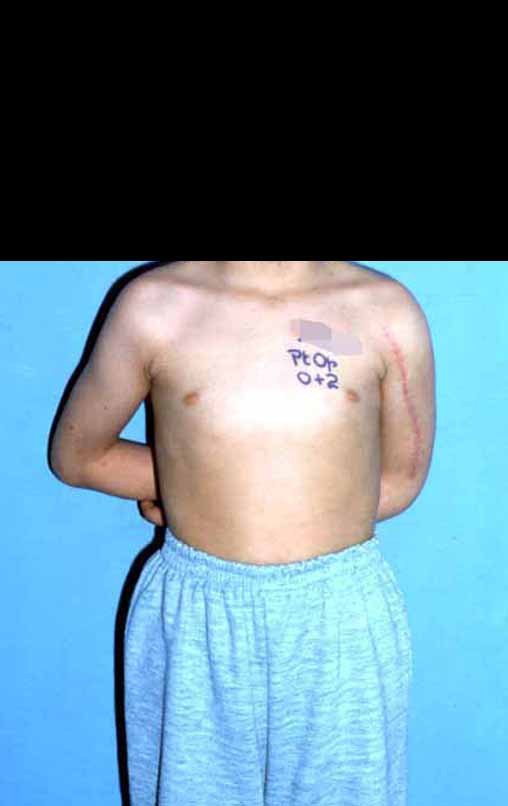
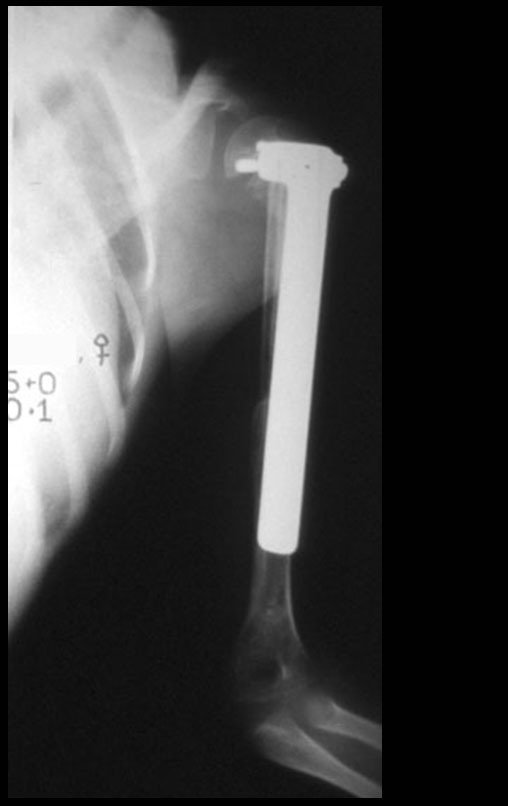
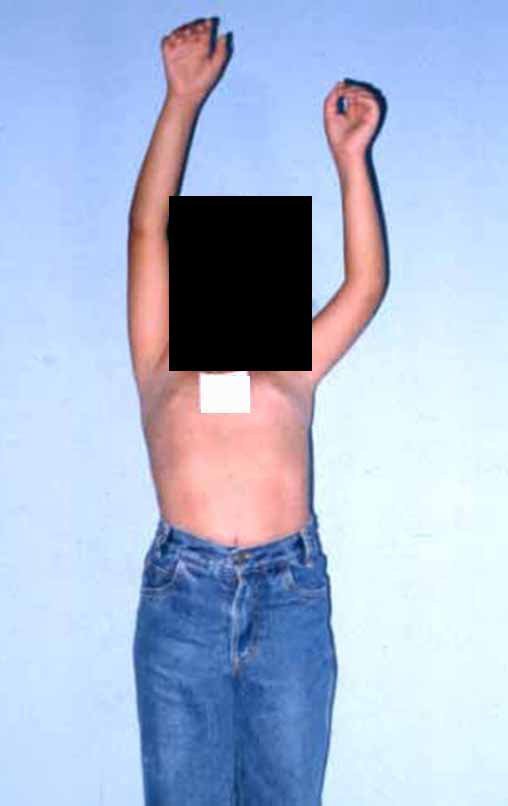
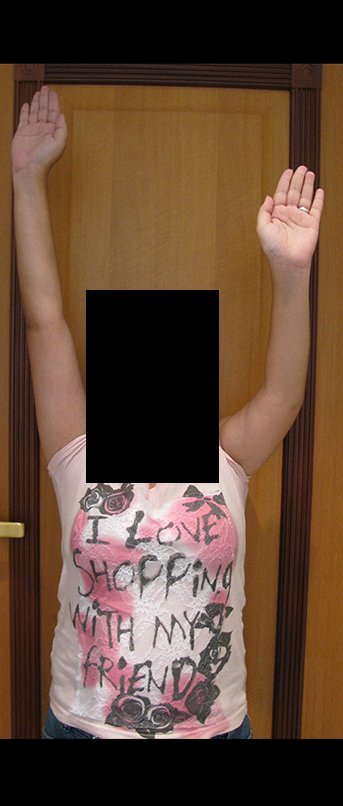
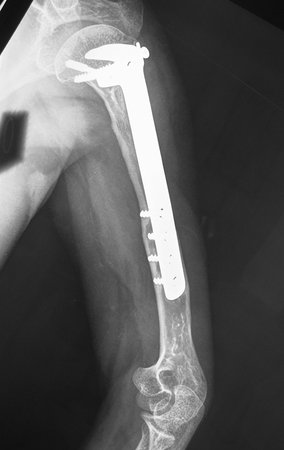
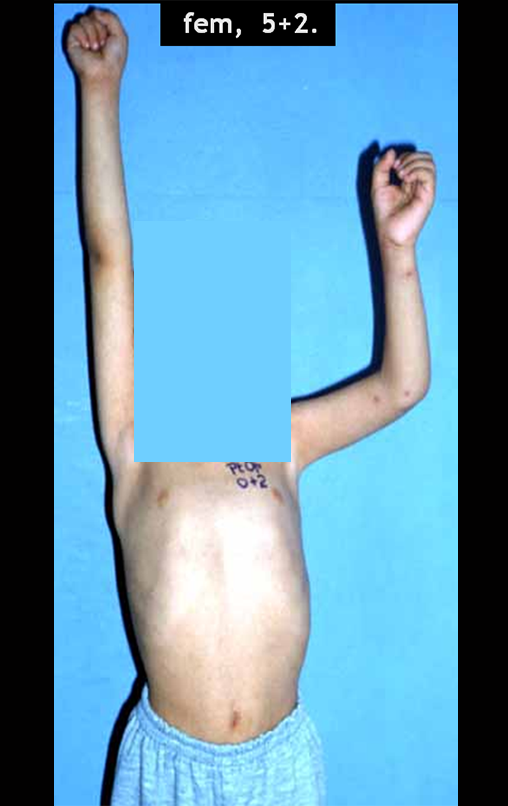
Sarcoma de Ewing do Úmero em Criança. Paciente com quatro anos e cinco meses de idade, apresentou dor e tumor no úmero esquerdo, em janeiro de 1991. A biópsia revelou tratar-se de Sarcoma de Ewing. O estadiamento não revelou outro foco. Submeteu-se a tratamento com quimioterapia neoadjuvante, apresentando boa resposta radiográfica ao tratamento, ocorrendo mineralização da lesão e deformidade angular pela plasticidade neoplásica, figuras 1 a 4.
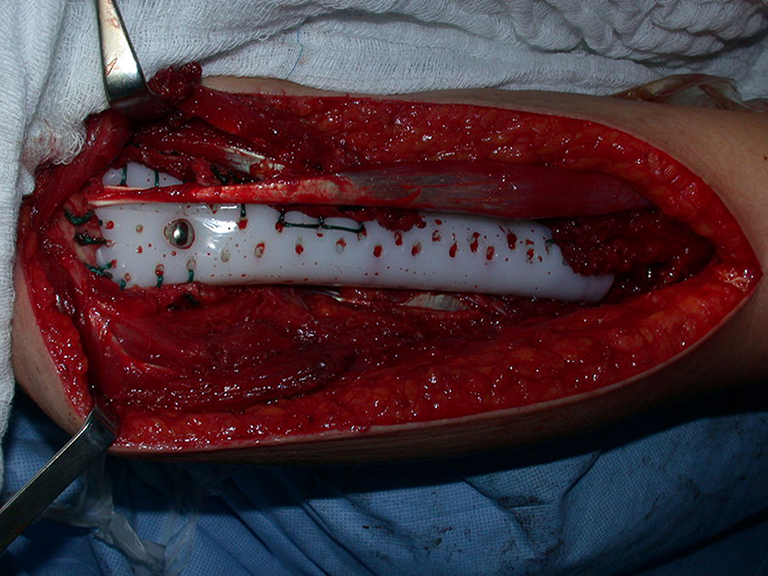
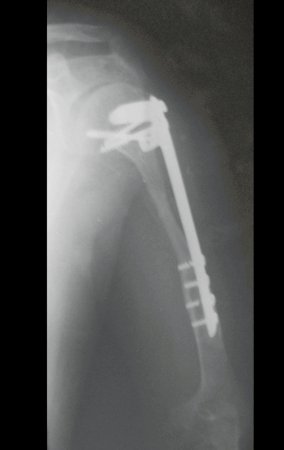
10. Sarcoma de Ewing do úmero em criança – Conduta – Técnicas de ressecção e de reconstrução com placa especial – Enxerto autólogo combinado de fíbula e ilíaco
A radiografia de controle com um mês de pós-operatório e a função do membro operado são mostradas nas figuras 11 a 14.
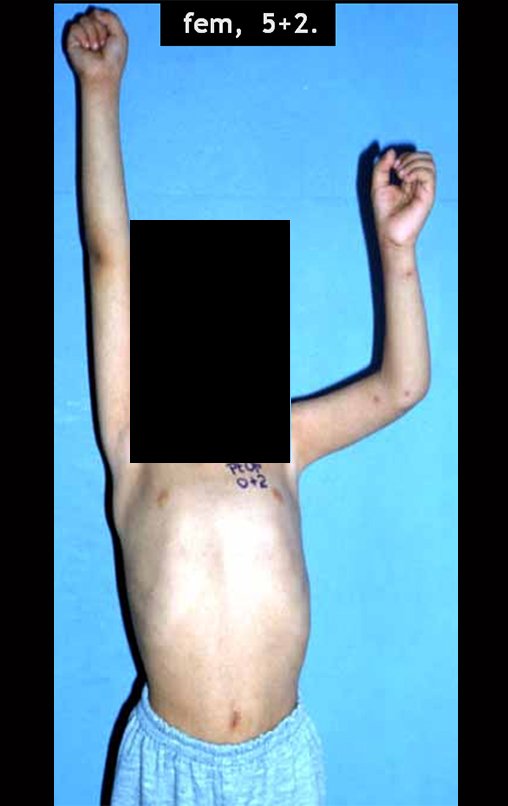
Vídeo 1: Boa estética, apesar do encurtamento, boa função, após 22 anos da cirurgia, em 11/01/2012.
As figuras 37 a 42, ilustram etapas da evolução deste caso de Sarcoma de Ewing, tratado cirurgicamente com uma solução biológica.
Em maio de 2015, a paciente teve o seu primeiro filho, dando luz à um menino. Em 1991 ainda não realizavamos o autotransplante de cartilagem de crescimento, reconstruindo este segmento com fíbula vascularizada com a placa de crescimento, para substituir a placa do úmero que quando esta é ressecada. Entretanto, o membro superior aceita melhor a discrepância de comprimento, coroando a alternativa que empregamos na época.
Autor: Prof. Dr. Pedro Péricles Ribeiro Baptista
Oncocirurgia Ortopédica do Instituto do Câncer Dr. Arnaldo Vieira de Carvalho
Consultório: Rua General Jardim, 846 – Cj 41 – Cep: 01223-010 Higienópolis São Paulo – S.P.
Fone:+55 11 3231-4638 Cel.:+55 11 99863-5577 Email: drpprb@gmail.com